
科目: 来源: 题型:
能正确表示下列反应的离子方程式为 ( )。
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO +OH-===CO
+OH-===CO +H2O
+H2O
B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+OH-===SO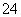 +Cl-+H2O
+Cl-+H2O
C.硫化钡加入稀硫酸:BaS+2H+===H2S↑+Ba2+
D.新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-+H2O===
2[Al(OH)4]-
查看答案和解析>>
科目: 来源: 题型:
有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是 ( )。
①Fe+Cu2+===Fe2++Cu
②Ba2++2OH-+2H++SO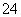 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
③Cl2+H2O===H++Cl-+HClO
④CO +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
⑤Ag++Cl-===AgCl↓
A.只有③ B.②③
C.③⑤ D.①④
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是 ( )。
A.氯化钠水溶液在电流的作用下电离出Na+和Cl-
B.硫酸钡难溶于水,但硫酸钡属于强电解质
C.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
D.硫酸钠在水中的电离方程式可表示为Na2SO4===2Na++S6++4O2-
查看答案和解析>>
科目: 来源: 题型:
硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:
3SiH4+4NH3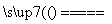 Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si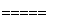 4NH3↑+SiH4↑+2MgCl2 ΔH<0
4NH3↑+SiH4↑+2MgCl2 ΔH<0
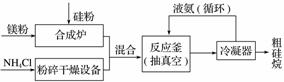
①NH4Cl中的化学键类型有______________________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是____________________________。
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式________________________________________________________________________,
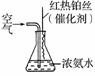
实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是______________。
(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为_____________________________________________。将0.184 g三硅酸镁加入到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中n的值为__________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)。
查看答案和解析>>
科目: 来源: 题型:
晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等。以下是工业上制取纯硅的一种方法。
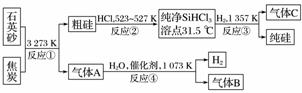
请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有________(填反应代号)。
(2)写出反应③的化学方程式_________________________________________。
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____________________________________。
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是__________(填化学式);分别通入W溶液中能得到白色沉淀的气体是______________(填化学式)。
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为________________________。
查看答案和解析>>
科目: 来源: 题型:
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为__________________,A与B在原子的电子层结构上的相同点是________________________________________________________________________
________________________________________________________________________。
(2)易与C发生化学反应的酸是________(写名称),反应的化学方程式是________________________________________________________________________。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式:___________________________________。
②要将纯碱高温熔化,下列坩埚中可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是____________________。
查看答案和解析>>
科目: 来源: 题型:
如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀。
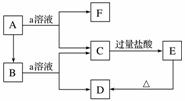
请回答下列问题:
(1)B的化学式是__________,目前B已被用作________的主要原料。
(2)B和a溶液反应的离子方程式是____________________________________________。
(3)A和a溶液反应的离子方程式是__________________________________________。
(4)C和过量的盐酸反应的离子方程式是________________________________________。
审题分析 本题应抓住框图中的转化关系,以题设条件C+过量盐酸—→E(白色沉淀)为突破口进行推断,并结合已有知识进行设定与推测。
查看答案和解析>>
科目: 来源: 题型:
甲气体可发生如下变化:
甲气体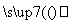 乙气体
乙气体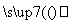 丙气体
丙气体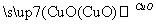 乙气体
乙气体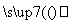 丁固体。则甲、乙、丙、丁分别为( )
丁固体。则甲、乙、丙、丁分别为( )
A.CO2、CO、O2、CaO
B.O2、CO、CO2、CaCO3
C.O2、CO2、CO、CaCO3
D.CO、CO2、O2、Ca(OH)2
查看答案和解析>>
科目: 来源: 题型:
用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此铅氧化物的化学式是( )
A.PbO B.Pb2O3 C.Pb3O4 D.PbO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com