
科目: 来源: 题型:
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
查看答案和解析>>
科目: 来源: 题型:
某溶液中可能含有H+、NH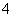 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO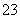 、SO
、SO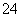 、NO
、NO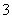 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
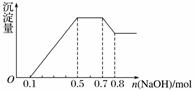
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH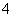 )=0.2 mol
)=0.2 mol
C.溶液中一定不含CO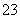 ,可能含有SO
,可能含有SO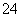 和NO
和NO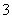
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目: 来源: 题型:
甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10 mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是( )
A.甲中沉淀一定比乙中的多
B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少
D.甲中和乙中的沉淀一定一样多
查看答案和解析>>
科目: 来源: 题型:
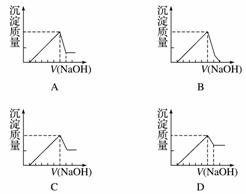
有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是( )
查看答案和解析>>
科目: 来源: 题型:
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质时,消耗碱量最多的是( )
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
查看答案和解析>>
科目: 来源: 题型:
下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②(NH4)2SO3 ③Al2O3 ④Al(OH)3 ⑤Al
A.全部 B.只有①③④⑤
C.只有③④⑤ D.只有②③④⑤
查看答案和解析>>
科目: 来源: 题型:
铝是一种低毒金属元素,它并非人体需要的微量元素,食用后不会导致急性中毒,但食品中铝的含量超过国家标准就会对人体造成危害。下列关于铝元素的说法正确的是( )
A.铝在空气中不易氧化是因为其性质不活泼
B.氢氧化铝可与胃酸反应,常用作中和胃酸的药物
C.明矾可用于饮用水的杀菌消毒
D.硫酸铝铵常用作面粉膨化剂,该物质不溶于水
查看答案和解析>>
科目: 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
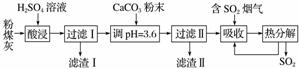
(1)酸浸时反应的化学方程式为________________________________;滤渣Ⅰ的主要成分为________________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________________________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是________________________________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是________________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com