
科目: 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置):
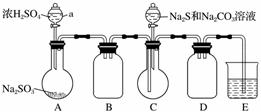
实验步骤:
(1)检查装置气密性,按图示加入试剂。
仪器a的名称是________;E中的试剂是________(选填下列字母编号)。
A.稀H2SO4
B.NaOH溶液
C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经__________(填写操作名称)、结晶、过滤、洗涤、干燥,得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。
(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是
________________________________________________________________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过________________方法提纯。
查看答案和解析>>
科目: 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
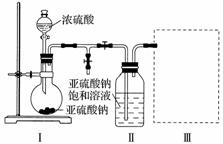
(1)装置Ⅰ中产生气体的化学方程式为_________________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是___________________________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为__________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO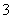 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是__________。
查看答案和解析>>
科目: 来源: 题型:
下列措施或叙述不合理的是( )
A.用SO2漂白纸浆和草帽辫(2013·广东理综,11A)
B.用硫酸清洗锅炉中的水垢(2013·广东理综,11B)
C.将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性(2013·广东理综,23A)
D.Na2SO3与H2O2的反应为氧化还原反应(2013·天津理综,1B)
查看答案和解析>>
科目: 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同( )
(2014·大纲全国卷,8A)
(2)用KOH溶液鉴别SO3(g)和SO2( )
(2014·重庆理综,2A)
(3)二氧化硫可广泛用于食品的增白( )
(2013·四川理综,1A)
(4)Na2S2O3溶液中加入稀硫酸的离子方程式:2S2O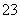 +4H+===SO
+4H+===SO +3S↓+2H2O( )
+3S↓+2H2O( )
(2013·四川理综,3D)
(5)用BaCl2溶液鉴别SO 与SO
与SO ( )
( )
(2012·广东理综,9B)
(6)浓硫酸有强氧化性,所以浓硫酸可用于干燥H2和CO( )
(2012·广东理综,12C)
查看答案和解析>>
科目: 来源: 题型:
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是____________________________ 。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO 、Br-、HCO
、Br-、HCO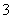 等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
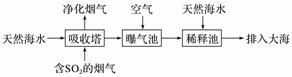
①向曝气池中通入空气的目的是_______________________________________________。
②通入空气后,曝气池中的海水与天然海水相比,浓度有明显不同的离子是________(填字母)。
a.Cl- b.SO c.Br- d.HCO
c.Br- d.HCO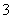
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
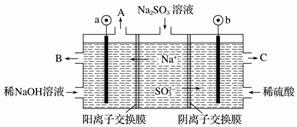
①图中a极连接电源的______(填“正”或“负”)极,C口流出的物质是________。
②SO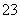 放电的电极反应为________________________。
放电的电极反应为________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释碱性增强的原因:________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 制得。实验室模拟该工业过程的装置如图所示。回答下列问题:

(1)b中反应的离子方程式为__________________________________,
c中试剂为____________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________。
(3)d中的试剂为______________。
(4)实验中要控制SO2生成速率,可以采取的措施有
________________________________________________________________________
___________________________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
某兴趣小组在实验室用铜和硫酸为原料,采用多种方法制取硫酸铜,制备方法如下:
方法一
(1)浓硫酸试剂瓶上适合贴上的标签是________(填序号)。

(2)甲同学取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲同学为了验证其中灰白色沉淀的主要成分,设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:_________________________________。
实验结论:所得灰白色固体的化学式为__________。
(3)乙还观察到加热过程中,试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失。淡黄色固体消失的原因是(用化学方程式回答)________________________________________________________________________。
直到最后反应完毕,发现试管中还有铜片剩余,乙根据自己所学的化学知识,认为试管中还有硫酸剩余。他这样认为的理由是________________________________________________________________________。
方法二
(4)丙同学认为甲设计的实验方案不好,他自己设计的思路是2Cu+O2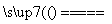 2CuO,CuO+H2SO4===CuSO4+H2O。
2CuO,CuO+H2SO4===CuSO4+H2O。
对比甲的方案,你认为丙同学的优点是①________________________________________________________________________;
②________________________________________________________________________。
方法三
(5)丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水发现溶液逐渐呈蓝色,写出反应的化学方程式________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
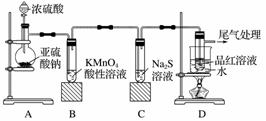
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为________________________________________________________________________。
(2)实验过程中,装置B、C中发生的现象分别是______________________、________________________________________________________________________;
这些现象分别说明SO2具有的性质是________________和________________;装置B中发生反应的离子方程式为________________________________。
(3)装置D的目的是探究SO2与品红反应的可逆性,请写出实验操作及现象________________________________________________________________________
________________________________________________________________________。
(4)尾气可采用________溶液吸收。
查看答案和解析>>
科目: 来源: 题型:
下图表示某固态
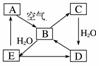
单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式:
________________________________________________________________________。
(2)写出E与A的氢化物反应生成A的化学方程式:
________________________________________________________________________。
(3)写出一个由D生成B的化学方程式:
________________________________________________________________________。
(4)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式:_____________________________;
②反应后溶液的pH________7(填“大于”、“小于”或“等于”),理由是________________________________________________________________________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com