
科目: 来源: 题型:
已知反应4CO+2NO2N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(CO)=1.5 mol·L-1·min-1
B.v(NO2)=0.7 mol·L-1·min-1
C.v(N2)=0.4 mol·L-1·min-1
D.v(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
查看答案和解析>>
科目: 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。回答下列问题:
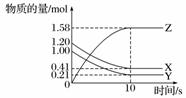
(1)从反应开始到10 s时,v(Z)=________________________________________________。
(2)反应的化学方程式为_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为+6价Cr。制三氯化铬的流程如下:
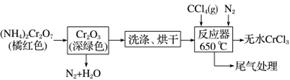
(1)重铬酸铵分解产生三氧化二铬(Cr2O3),其分解的化学方程式为________________________________________________________________________。
(2)已知CCl4沸点为57.6 ℃,为保证稳定的CCl4气流,适宜的加热方式是______________。
(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400 ℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650 ℃;③三颈烧瓶中装入150 mL CCl4,并加热CCl4,温度控制在50~60 ℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性。正确的顺序:⑥→③→________________,步骤②中通入氮气的目的是________________________________________________________________________。
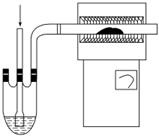
(4)已知反应管中发生的主要反应有Cr2O3+3CCl4—→2CrCl3+3COCl2,因光气有剧毒,故实验需在通风橱中进行,并用浓氨水处理COCl2,生成两种常见的氮肥,它们分别是__________________(写名称)。
(5)样品中三氯化铬质量分数的测定:
称取样品0.330 0 g,加水溶解并配成250 mL溶液。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g Na2O2,充分加热煮沸,适当稀释,然后加入过量的2 mol·L-1 H2SO4至溶液呈强酸性,此时铬以Cr2O 存在,再加入过量KI,塞上塞子,摇匀,于暗处静置5 min后,加入1 mL指示剂,用0.025 0 mol·L-1硫代硫酸钠标准溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00 mL。
存在,再加入过量KI,塞上塞子,摇匀,于暗处静置5 min后,加入1 mL指示剂,用0.025 0 mol·L-1硫代硫酸钠标准溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00 mL。
已知:Cr2O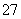 +6I-+14H+===2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
+6I-+14H+===2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①该实验可选用的指示剂名称为______________。
②本实验除移液管、碘量瓶、烧杯外,还需要的玻璃仪器有______________。
③样品中无水三氯化铬的质量分数为________(计算结果精确到0.1%)。
查看答案和解析>>
科目: 来源: 题型:
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
装置C中发生反应:2NaClO3+SO2===2ClO2+Na2SO4(Ⅰ)
装置D中发生反应:2ClO2+H2O2+2NaOH===2NaClO2+2H2O+O2(Ⅱ)
(1)仪器组装完毕,关闭两个弹簧夹,打开A中活塞,向A中注入水可检验装置气密性,装置气密性良好的现象是________________________。实验开始时,打开A的活塞,两个弹簧夹的开关操作是__________________,F中盛有的液体为________。
(2)装置B中进行的是用硫酸与亚硫酸钠制备二氧化硫的反应,该处使用的是70%~80%的硫酸,而不是98%的浓硫酸或极稀的硫酸,原因是___________________________________。
(3)装置C的作用是________________,装置E的作用是________________。
(4)在碱性溶液中NaClO2比较稳定,所以装置D中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是________。
a.稀盐酸 b.品红溶液 c.石蕊溶液 d.酚酞溶液
(5)一次实验制备中,通过检验发现制备的NaClO2中含有NaOH、Na2SO3,出现这些杂质的可能原因是__________________。检验产物中含有Na2SO3杂质的实验操作和现象是________________________________________________________________________。
(供选择的试剂有:Ba(OH)2溶液、H2O2溶液、AgNO3溶液、品红溶液、H2SO4溶液)
查看答案和解析>>
科目: 来源: 题型:
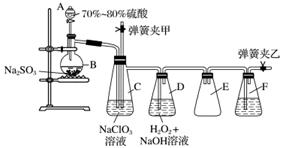
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下所示:
(1)验证固体W焙烧后产生的气体中含有SO2的方法是
________________________________________________________________________。
(2)制备绿矾时,向溶液X中加入过量__________,充分反应后,经__________操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(3)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为________________________________________________________________________。
若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”或“偏小”)。
查看答案和解析>>
科目: 来源: 题型:
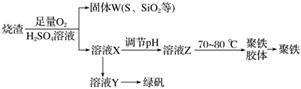
工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3和NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
Ⅰ.提供的装置

Ⅱ.NH3的制取
(1)下列有关实验室制备气体的说法正确的是________(填序号)。
①可以用排饱和食盐水的方法收集氯气 ②用赤热的炭与水蒸气反应制取氢气 ③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气 ⑤用浓盐酸洗涤高锰酸钾分解制氧气的试管
(2)从所提供的装置中选取一个能制取氨气的装置:__________________________(填字母)。
(3)当采用你所选用的装置制取氨气时,相应反应的化学方程式是________________________________________________________________________。
Ⅲ.模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
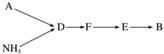
(4)A中反应的离子方程式为_______________________________________________
________________________________________________________________________。
(5)装置D的作用有:使气体混合均匀、调节气流速度,还有一个作用是________________________________________________________________________。
(6)D装置中的液体可换成________(填字母)。
a.CuSO4 b.H2O c.CCl4 d.浓硫酸
(7)该同学所设计的模拟尾气处理实验还存在的明显缺陷是____________________________。
查看答案和解析>>
科目: 来源: 题型:
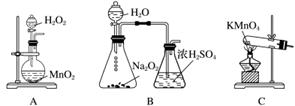
实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气,某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气。供选用的实验试剂及装置如下图所示(部分导管、蒸馏水略)。
a.Na2O2 b.浓盐酸 c.碱石灰 d.NaOH溶液 e.淀粉KI溶液 f.CaCO3 g.石蕊溶液 h.饱和NaCl溶液
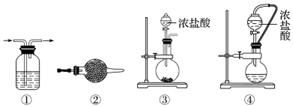
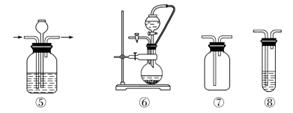
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式:__________________________
________________________________________________________________________
________________________________________________________________________。
(2)下表中的装置组合最合理的是__________(填字母,需考虑实验结束撤除装置时残留有害气体的处理)。
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为________________________________________________________________________。
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇,在工业上应用广泛。工业上制取氯化亚铜的工艺流程如下:
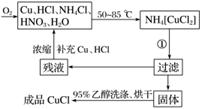
实验药品:铜丝20 g、氯化铵20 g、65%硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为________________________________________________,
用95%乙醇代替蒸馏水洗涤的主要目的是____________________________________________
________________________________________________________________________(写出一条即可)。
(2)工业化生产时,95%乙醇可通过__________的方法回收并循环利用,而NH4Cl、____________(填化学式)可直接循环利用。
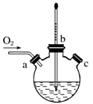
(3)实验室用右图装置制备CuCl。
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择下列装置中的________(填字母)。
②实验开始时,温度计显示反应液温度低于室温,主要原因是________________________________________________________________________
________________________________________________________________________。
电炉加热升温至50 ℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当______________________________时才能停止通入氧
气;待冷却至室温后,再打开瓶塞,沿________(填字母)口倾出棕色反应液于1 000 mL大烧杯中,加水500 mL,即有大量白色沉淀析出。
查看答案和解析>>
科目: 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
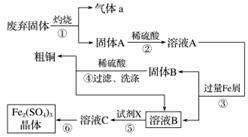
(1)③实验操作中用到的玻璃仪器有________________________________________。
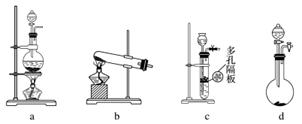
(2)③④操作中会有一种气体生成,若在实验室制备该气体,可选择下列哪些装置________(填字母)。
(3)溶液B在空气中放置有可能变质,如何检验溶液B是否变质:__________________。
(4)溶液B加稀硫酸酸化后加强氧化剂X,试剂X最好选择下列哪种试剂______________(填字母)。
a.Cl2 b.H2O2 c.KMnO4
试剂X在酸性条件下与溶液B反应的离子方程式为________________________。
(5)由溶液C经________、________、过滤等操作得Fe2(SO4)3晶体。
(6)某同学用实验制得的Fe2(SO4)3晶体配制0.1 mol·L-1的Fe2(SO4)3溶液,在称量出Fe2(SO4)3晶体后,溶解该晶体的具体操作为_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com