
科目: 来源: 题型:
下列说法正确的是( )
①参加反应的物质的性质是影响化学反应速率的主要因素
②光是影响某些化学反应速率的外界条件之一 ③决定化学反应速率的主要因素是浓度 ④不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目: 来源: 题型:
某反应过程中能量变化如图所示,下列有关叙述正确的是( )
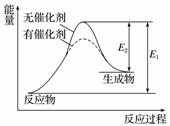
A.该反应为放热反应
B.催化剂改变了化学反应的热效应
C.催化剂不改变化学反应过程
D.催化剂改变了化学反应速率
查看答案和解析>>
科目: 来源: 题型:
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O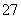 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
 测得实验①和②溶液中的Cr2O
测得实验①和②溶液中的Cr2O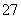 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为________(填化学式)。
(3)实验①和②的结果表明________;实验①中0~t1时间段反应速率v(Cr3+)=________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:________;
假设三:________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O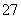 的浓度可用仪器测定]
的浓度可用仪器测定]
| 实验方案 | |
| (不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目: 来源: 题型:
催化反硝化法可用于治理水中硝酸盐的污染,H2能将NO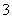 还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12,上述反应的离子方程式为________________________________________________________________________
还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12,上述反应的离子方程式为________________________________________________________________________
________________________________________________________________________,
其平均反应速率v(NO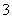 )为________ mol·L-1·min-1。
)为________ mol·L-1·min-1。
查看答案和解析>>
科目: 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2,0.1 mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
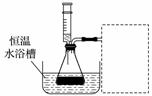
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:________________________________________________________________________。
②设计实验方案:在不同H2O2浓度下,测定________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成上图的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1 mol·L-1 Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
查看答案和解析>>
科目: 来源: 题型:
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是( )
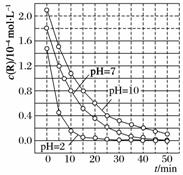
A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间, pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是( )
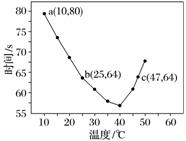
A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1
D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,N2O分解的部分实验数据如下:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O)/mol·L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间/min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O)/mol·L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
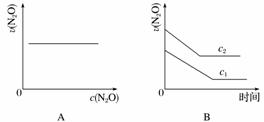
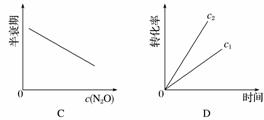
查看答案和解析>>
科目: 来源: 题型:
一定温度下,10 mL 0.40 mol·L-1 H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:
v(H2O2)≈3.3×10-2 mol·L-1·min-1
B.6~10 min的平均反应速率:
v(H2O2)<3.3×10-2 mol·L-1·min-1
C.反应到6 min时,c(H2O2)=0.30 mol·L-1
D.反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目: 来源: 题型:
COCl2的分解反应为COCl2(g)===Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):

①计算反应在第8 min时的平衡常数K=__________;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________mol·L-1;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小_____________________________;
⑤比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小:v(5~6)________v(15~16)(填“<”、“>”或“=”),原因是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com