
科目: 来源: 题型:
相同体积、相同pH值的盐酸和醋酸
①加入足量的Zn,在丙图中画出H2体积的变化图像

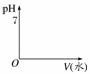
丙 丁
单位时间内,________产生的H2多,反应停止时,______产生的H2多。
查看答案和解析>>
科目: 来源: 题型:
按要求画出图像,并回答下列问题。
(1)相同体积、相同浓度的盐酸和醋酸
①加入足量的Zn,在甲图中画出H2体积的变化图像


甲 乙
单位时间内,________产生的H2多,反应停止时,产生的H2________。
查看答案和解析>>
科目: 来源: 题型:
常温下,将a mol·L-1 CH3COONa溶于水配成溶液,向其中滴加等体积的b mol·L-1的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=________。
查看答案和解析>>
科目: 来源: 题型:
在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显__________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________________________________________________。
)=c(Cl-),则溶液显__________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO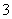 +H+的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
+H+的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
查看答案和解析>>
科目: 来源: 题型:
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________。
(2)同浓度的CH3COO-、HCO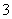 、CO
、CO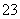 、ClO-结合H+的能力由强到弱的顺序为____________。
、ClO-结合H+的能力由强到弱的顺序为____________。
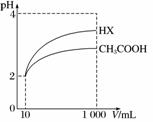
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
在Na2CO3中加醋酸产生CO2气体,试从电离平衡常数的角度解释原因[已知:K(CH3COOH)=1.7×10-5;K(H2CO3)=4.3×10-7。]:_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
H2CO3的电离平衡常数Ka1=4.3×10-7,Ka2=5.6×10-11,它的Ka1、Ka2差别很大的原因(从电离平衡的角度解释):_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com