
科目: 来源: 题型:
下列变化中,属于物理变化的是( )
①加热氨水可得到氨气
②氯化铵晶体受热后由试管底部移到试管上部
③固体碘受热变成紫红色气体
④液氨汽化
⑤浓硝酸从无色液体变成黄色液体
A.①③④ B.③④
C.②③④ D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式正确的是 ( )
A.铝片和氢氧化钠溶液反应:Al+2OH—=AlO2—+H2↑
B.Cl2通入冷水中:Cl2+H2O=Cl-+ClO-+2H+
C.铜与稀硝酸反应:3Cu+2NO3—+8H+=3Cu2++2NO↑+4H2O
D.小苏打溶液跟澄清的石灰水反应:HCO3—+OH-=CO32-+H2O
查看答案和解析>>
科目: 来源: 题型:
在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol·L-1和0.1mol·L-1。向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度(mol·L-1)是: ( )
A.0.15 B.0.225 C.0.35 D.0.45
查看答案和解析>>
科目: 来源: 题型:
常温下,在密闭容器中将物质的量相同的下列各组气体混合,完全反应后容器中压强没有发生变化的是 ( )
A.H2S和SO2 B.NO和O2 C.HI和Cl2 D.H2S和Cl2
查看答案和解析>>
科目: 来源: 题型:
下列各组离子能大量共存的是 ( )A.Na+、Ba2+、S2-、SO32- B.H+、K+、HS-、SO42-
C.Fe2+、H+、Cl-、NO3- D.K+、NH4+、SO42-、NO3-
查看答案和解析>>
科目: 来源: 题型:
有关氨气的实验较多,下面对这些实验的实验原理的分析中,正确的是( )
A.氨气极易溶解于水的性质可以解释氨气的喷泉实验
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因
D.氨水的热稳定性强可以解释实验室中用加热氨水的方法制取氨气
查看答案和解析>>
科目: 来源: 题型:
乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45 ℃,沸点:180.8 ℃,它是有机合成中常用的原料。在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为
2CH3COOC2H5C2H5ONa,CH3COCH2COOC2H5+C2H5OH
反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
金属钠,有机液体回流①,钠熔化振荡②,小米状钠珠回收有机液体③,加入乙酸乙酯④,橘红色溶液乙酸酸化⑤,含乙酰乙酸乙酯的混合物⑥,⑦,乙酰乙酸乙酯粗产品
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题。
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度/(g·cm-3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点/℃ | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点/℃ | 881.4 | 80 | 111 | 138.4 | 76.8 |
最好选用________来熔化钠。是否能用四氯化碳?________(填“是”或“否”),理由是________________________________________________________________________。
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管。缓缓加热,保持瓶中混合液微沸状态。在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是_______________________________,
烧瓶配上长导管的作用是______________________________________________,
导管上端接一干燥管的目的是______________________________________________。
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是
________________________________________________________________________,
写出步骤⑦实验操作的主要仪器____________(填最主要一种)。
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品。
粗产品无水硫酸钠,过滤,水浴蒸馏,减压蒸馏,乙酰乙酸乙酯
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是________________________________________________________________________。
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示。
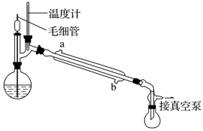
冷凝管的进出水方向应________口进,________口出(填“a”或“b”)。毛细管的作用是________________________________________________________________________。
(6)实验最后所得产品远少于完全转化的理论产值,除了反应过程中的损耗外,主要原因是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com