
科目: 来源: 题型:
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一: 甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
该同学的实验目的是研究_____________对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持__________相同。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1) 针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想反应速率明显加快的原因还可能是_________ _。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还需要选择的试剂最合理的是 (选填编号)。
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
查看答案和解析>>
科目: 来源: 题型:
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)用pH试纸测定HA溶液pH的操作方法为 。
(3)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
(4)乙方案中,说明HA是弱电解质的现象是 (选填编号)。
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
查看答案和解析>>
科目: 来源: 题型:
为了完成教材上的“中和热的测定”这个实验
(1)实验桌上有烧杯(大、小两个)、泡沫塑料、泡沫塑料板(中心有两个小孔)、环形玻璃搅拌棒,0.50mol·L-1盐酸、0.55mol·L—1NaOH溶液,尚缺少的实验用品是 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?答: (填“能”或“否”)。其原因是 。
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g·cm—3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式: 。
(4)如果用50mL的0.60mol·L-1盐酸与50mL 的0.55mol·L—1NaOH溶液进行反应。若热量无损失,与上述实验相比,所求中和热 (填“偏大、偏小、相等”),简述理由 。
查看答案和解析>>
科目: 来源: 题型:
请认真观察右图,然后回答问题:
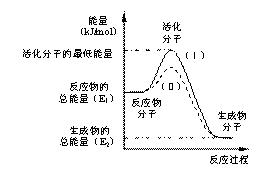 (1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=___________ (用含E1、E2的代数式表示)。
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=___________ (用含E1、E2的代数式表示)。
(2)已知热化学方程式:
H2(g)+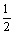 O2(g)= H2O(g)
O2(g)= H2O(g)
△H=-241.8 kJ/mol,
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为_______________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能 ,活化分子百分数 ,反应速率 ,(Ⅱ)相对(Ⅰ)改变的外界条件是_________。这一改变对反应热_________(填“有”、“无”)影响,原因是 。
查看答案和解析>>
科目: 来源: 题型:
某温度下,H2(g)+CO2(g) 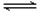 H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。

下列判断不正确的是
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目: 来源: 题型:
100mL6mol·L-1硫酸跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,加入下列物质不能达到实验目的的是
A.硫酸钠(aq) B.硝酸钾(aq) C.醋酸钠(s) D.水
查看答案和解析>>
科目: 来源: 题型:
在一密闭容器中,反应aA(g) 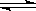 bB(g)达平衡后,保持温度不变,将容器体积压缩至一半,当达到新的平衡时,B的浓度是原来的160%,则正确的是
bB(g)达平衡后,保持温度不变,将容器体积压缩至一半,当达到新的平衡时,B的浓度是原来的160%,则正确的是
A.a>b B.物质A的转化率增大了
C.物质A的质量分数减小了 D.平衡向逆反应方向移动了
查看答案和解析>>
科目: 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g) △H=-92.6 kJ·mol-1
2XY3(g) △H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热 23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | a kJ |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为23.15 kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
查看答案和解析>>
科目: 来源: 题型:
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0
在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.其他条件不变,充入惰性气体,正逆反应速率均不发生变化,平衡不移动
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目: 来源: 题型:
如下图反应:X(g) + 3 Y(g)  2 Z(g)(正反应是放热反应),在不同温度不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线是
2 Z(g)(正反应是放热反应),在不同温度不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线是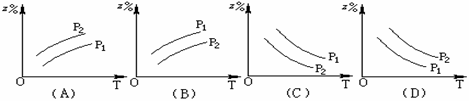
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com