
科目: 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲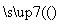 乙
乙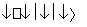 丙。下列有关物质的推断不正确的是( )
丙。下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目: 来源: 题型:
下列物质的转化在给定条件下不能实现的是( )
A.Ca(ClO)2(aq)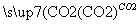 HClO(aq)
HClO(aq)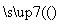 HCl(aq)
HCl(aq)
B.H2SiO3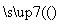 SiO2
SiO2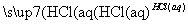 SiCl4
SiCl4
C.Al2O3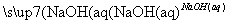 NaAlO2(aq)
NaAlO2(aq)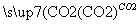 Al(OH)3
Al(OH)3
D.Fe2O3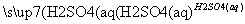 Fe2(SO4)3(aq)
Fe2(SO4)3(aq)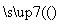 无水Fe2(SO4)3
无水Fe2(SO4)3
查看答案和解析>>
科目: 来源: 题型:
下列物质的转化在给定条件下能实现的是( )
①NaAlO2(aq)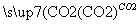 Al(OH)3
Al(OH)3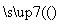 Al2O3(熔融)
Al2O3(熔融)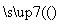 Al
Al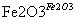 Fe
Fe
②S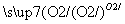 SO3
SO3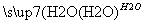 H2SO4
H2SO4
③Cu2(OH)2CO3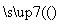 CuCl2(aq)
CuCl2(aq)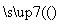 Cu
Cu
④Fe2O3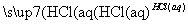 FeCl3
FeCl3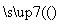 无水FeCl3
无水FeCl3
⑤饱和NaCl(aq)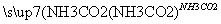 NaHCO3
NaHCO3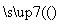 Na2CO3
Na2CO3
A.①③⑤ B.②③④
C.②④⑤ D.①④⑤
查看答案和解析>>
科目: 来源: 题型:
利用自然资源制备相关化学物质,下列化学工艺不可行的是( )
A.FeS2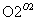 SO2
SO2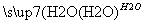 H2SO3
H2SO3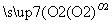 H2SO4
H2SO4
B.石英砂 粗硅
粗硅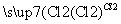 粗SiCl4
粗SiCl4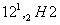 高纯硅
高纯硅
C.提取食盐后的母液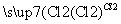 含Br2的液体
含Br2的液体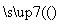
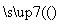 粗Br2
粗Br2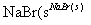 Br2
Br2
D.铝土矿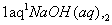 NaAlO2(aq)
NaAlO2(aq)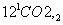 Al(OH)3
Al(OH)3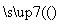 Al2O3
Al2O3 Al
Al
查看答案和解析>>
科目: 来源: 题型:
一定条件下,反应N2(g)+3H2(g) 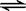 2NH3(g ) 在10L的密闭容器中进行,
2NH3(g ) 在10L的密闭容器中进行,
(1)测得2min内,N2的物质的量由20mol减小到8mol,则2min内H2的反应速率为_____。
(2)当该反应达到化学平衡时,则其平衡常数表达式为 ,如果此时向容器中增加氮气,那么氢气的转化率会 (填增大或降低)。
(3)生成物氨气能与水反应,生成的一水合氨属于 (填强电解质或弱电解质)。
(4)在含有酚酞的0.1 mol / L氨水中加少量的 NH4Cl晶体,则溶液颜色____(填字母)。
A.变蓝色 B.变深 C.变浅 D.不变
(5)工业合成氨的反应为N2(g)+3H2(g)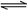 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为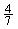 。求(写出计算过程)
。求(写出计算过程)
① 该条件下N2的平衡转化率;
② 该条件下反应2NH3(g)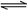 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
查看答案和解析>>
科目: 来源: 题型:
二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125 mol/L)。下图中的曲线表示二氧化氮分解反应在前25秒内的反应进程。

(1)请计算前20秒内氧气的平均生成速率为_______________。
(2) 若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线。
(3) 若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加入催化剂后的反应进程曲线。
(4)写出该反应的化学平衡常数表达式K=_______________。
查看答案和解析>>
科目: 来源: 题型:
“中和热的测定”实验步骤为:
① 准备反应装置(如右图)。
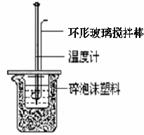
② 用一个量筒量取40 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记录。然后把温度计上的酸用水冲洗干净。
③ 用另一个量筒量取40 mL 0.55 mol/LNaOH溶液,并用温度计测量NaOH溶液的温度,记录。
④ 把温度计和_____________________放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度。
⑤_____________________________________________________________________。
⑥ 根据实验数据计算中和热。
请回答下列问题
(1)补全第④步中所缺仪器__________________。
(2)补全第⑤步操作步骤__________________。
(3)第②步如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的ΔH__________________。(填“偏大”“偏小”或“无影响”)。
(4)近似认为0.50 mol/L盐酸0.55 mol/LNaOH溶液的密度都是1g/mL,中和后生成的溶液的比热容c=4.18J/(g·℃),起始平均温度为t1℃,反应后最高温度为t2℃,则中和热(不用化简):
ΔH=__________________。
(5)0.50L 1.00 mol/L H2SO4溶液与1.00 L 1.00 mol/L NaOH溶液完全反应,放出57.16kJ的热量,写出该中和反应的热化学方程式
__________________________________________________________________。
(6)_______(填“能”或“不能”)用稀Ba(OH)2和稀硫酸代替盐酸和NaOH溶液,理由是____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
向某一容积为5 L的密闭容器中,加入 0.2 mol CO和0.2 mol H2O,在800℃和催化剂的条件下,发生如下反应:CO(g)+H2O(g) 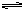 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
(1)由图可知,反应从开始至达到平衡时,CO的化学反应速率v(CO)= ;H2的物质的量浓度c(H2)= ;该温度下此反应的平衡常数K= 。
(2)能说明该反应已达到平衡状态的是 (填序号)。
①CO、H2O、CO2、H2的浓度都相等
②密闭容器内压强保持不变
③CO减少的化学反应速率和CO2减少的化学反应速率相等
④CO、H2O、CO2、H2的浓度都不再发生变化
⑤密闭容器内密度保持不变
(3)若开始时向该容器中加入CO、H2O(g)、CO2和H2各0.1 mol,在相同条件下,反应达到平衡时,水蒸气的物质的量浓度c(H2O)= 。
(4)查表已知BaSO4(s)+4C(s)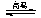 4CO(g)+BaS(s) △H1= +571.2 kJ·mol-1 ①
4CO(g)+BaS(s) △H1= +571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)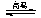 2CO2(g)+BaS(s) △H2= +226.2 kJ·mol-1 ②
2CO2(g)+BaS(s) △H2= +226.2 kJ·mol-1 ②
则反应C(s)+CO2(g)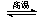 2CO(g)的△H= 。
2CO(g)的△H= 。
查看答案和解析>>
科目: 来源: 题型:
对可逆反应A(气)+2B(气)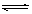 2C(气)△H<0的平衡体系,下列说法错误的是
2C(气)△H<0的平衡体系,下列说法错误的是
A.使用催化剂,v正、v逆都改变,变化的倍数相同
B.升高温度,v正、v逆都增大,v正增大的倍数小于v逆增大的倍数
C.增大压强,v正、v逆反应的速率都增大,v正增大的倍数大于v逆增大的倍数
D.降低温度,v正、v逆都减小,v正减小的倍数大于v逆减小的倍数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com