
科目: 来源: 题型:
100℃时水的离子积约为1.0×10-12,则此时纯水中C(H+)= ,
PH= ,溶液呈 性;此温度下,0.05mol/L的硫酸的PH= ,0.1mol/L的氢氧化钠溶液的PH=
查看答案和解析>>
科目: 来源: 题型:
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=====CO2(g) ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=====2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g) ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
查看答案和解析>>
科目: 来源: 题型:
向某一容积为5 L的密闭容器中,加入 0.2 mol CO和0.2 mol H2O,在800℃和催化剂存在的条件下,发生如下反应:CO(g)+H2O(g) 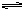 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
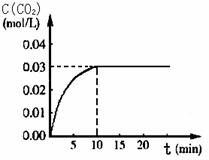
(1)由图中数据可知,反应从开始至达到平衡时,CO的化学反应速率v(CO)= ; H2的物质的量浓度c(H2)=_____________;该温度下此反应的平衡常数K= 。
(2)判断该反应是否达到平衡状态的依据是________________(填序号)。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为0
(3)若开始时向该容器中加入CO、H2O(g)、CO2和H2各0.1 mol,在相同条件下,反应达到平衡时,水蒸气的物质的量浓度c(H2O)=_______________。
查看答案和解析>>
科目: 来源: 题型:
对于下列反应:A(g) +3B(g)  2C(g),如果2min内B的浓度由8 mol/L下降为2 mol/L,那么,用B的浓度变化表示的化学反应速率为 ;若在一定温度下该反应达到平衡,则其平衡常数表达式为 ;若各物质的平衡浓度分别为C(A)=3mol/L、C(B)=2mol/ L 、C(C)=1mol/L,则K= 。
2C(g),如果2min内B的浓度由8 mol/L下降为2 mol/L,那么,用B的浓度变化表示的化学反应速率为 ;若在一定温度下该反应达到平衡,则其平衡常数表达式为 ;若各物质的平衡浓度分别为C(A)=3mol/L、C(B)=2mol/ L 、C(C)=1mol/L,则K= 。
查看答案和解析>>
科目: 来源: 题型:
(1)在① NaCl ②CH3COONa ③ NH4Cl三种盐溶液中,
常温下呈中性的是 (填序号,下同);呈酸性的是 ,
原因是 (用离子方程式表示,下同);呈碱性的是 ,原因是 。
(2)氯化铁水解的离子方程式为 ,配制氯化铁溶液时滴加少量盐酸的作用是 。
查看答案和解析>>
科目: 来源: 题型:
在100℃时,将0.50 mol N2O4气体通入到体积为5.0 L的真空密闭容器中立即出现红棕色,反应进行到2秒时,NO2的浓度为0.02 mol/L,60秒时体系已达平衡,此时容器内压强为开始的1.6倍,下列说法正确的是
A、前2秒以N2O4的浓度变化表示的平均反应速率为0.010 mol/(L·s)
B、在2秒时体系内压强为开始时的1.1倍
C、平衡时体系内含N2O4 为0.25mol
D、平衡时如果压缩容器体积,则可以提高N2O4的转化率
查看答案和解析>>
科目: 来源: 题型:
室温下,某一元碱A与0.01 mol/L某一元强酸等体积混合后所得溶液的pH为7。下列说法中正确的是
①若A为强碱,其溶液的物质的量浓度等于0.01 mol/L
②若A为弱碱,其溶液的物质的量浓度大于0.01 mol/L
③反应前,A溶液中c(OH-)一定是0.01 mol/L
④反应后,混合溶液中阴离子的总浓度大于阳离子的总浓度
A.①② B.③④ C.①②③ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
恒温恒压下,在容积可变的器皿中,反应2NO2(g)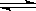 N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A、不变 B、 增大 C、 减少 D、 无法判断
查看答案和解析>>
科目: 来源: 题型:
25℃时,水的电离达到平衡H2O 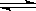 H++OH- Δ H >0。下列说法正确的是
H++OH- Δ H >0。下列说法正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.加热,Kw增大,pH不变
查看答案和解析>>
科目: 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是:
A、反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B、反应开始到10 s时,Y的转化率为79.0%
C、反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
D、反应的化学方程式为:X(g)+Y(g)=Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com