
科目: 来源: 题型:
关于原子结构、元素性质的说法正确的是:
A.随原子序数的递增,元素原子的核外电子数逐渐增多,原子半径逐渐减小
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.若两种元素原子的最外层电子数相同,则元素最高正价一定相同
D.电子层结构相同的微粒,其化学性质一定相似
查看答案和解析>>
科目: 来源: 题型:
下列反应属于放热反应的是:
①稀硫酸与氢氧化钾溶液反应 ②锌与稀硫酸的反应
③生石灰变成熟石灰的反应 ④氢氧化钡晶体和氯化铵晶体混合反应
⑤石灰石高温煅烧 ⑥灼热的炭与CO2反应
⑦甲烷与O2的燃烧反应
A.①②③⑤ B.①②③⑦ C.①②⑤⑥⑦ D.④⑥
查看答案和解析>>
科目: 来源: 题型:
欲降低废水中重金属元素铬的毒性,可将Cr2O 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
| 离子 | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
(1)某含铬废水处理的主要流程如图所示:
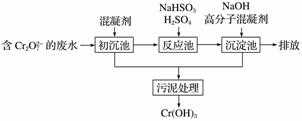
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为________________________(用离子方程式表示)。
②反应池中发生主要反应的离子方程式是Cr2O +3HSO
+3HSO +5H+===2Cr3++3SO
+5H+===2Cr3++3SO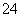 +4H2O。根据“沉
+4H2O。根据“沉
淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是________________________________________________________________________、
________________________________________________________________________。
证明Cr3+沉淀完全的方法是_________________________________________________。
(2)工业可用电解法来处理含Cr2O 废水。实验室利用如图装置模拟处理含Cr2O
废水。实验室利用如图装置模拟处理含Cr2O 的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+
的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+
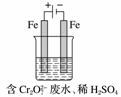
与酸性溶液中的Cr2O 反应的离子方程式是
反应的离子方程式是
________________________________________________________________________,
得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01 mol Cr2O 时,得到沉淀的质量至少是________g。
时,得到沉淀的质量至少是________g。
查看答案和解析>>
科目: 来源: 题型:
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如下图所示。
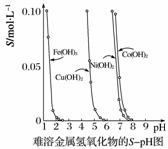
(1)pH=3时溶液中铜元素的主要存在形式是________(写化学式)。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为______(填字母)。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______________________________________________。
(4)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的________除去它们(填字母)。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目: 来源: 题型:
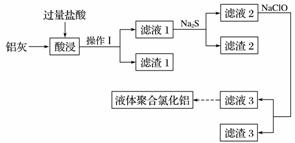
以铝灰(主要成分为Al 、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝[Alm(OH)nCl3m-n],生产的部分过程如下图所示(部分产物和操作已略去)。
已知某些硫化物的性质如下表:
| 物质 | 性质 |
| Fe2S3、Al2S3 | 在水溶液中不存在 |
| FeS | 黑色,难溶于水,可溶于盐酸 |
| CuS | 黑色,难溶于水,难溶于盐酸 |
(1)操作Ⅰ是______________。Al2O3与盐酸反应的离子方程式是________________________。
(2)滤渣2为黑色,该黑色物质的化学式是___________________________________________。
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7。NaClO的作用是________________________________________________________________________。
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝。反应的化学方程式是________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
(1)碱性:Sr(OH)2____Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是______________。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
①Ⅰ中,反应的化学方程式是_________________________________________。
②Ⅱ中,能与盐酸反应溶解的物质有_________________________________。
③Ⅳ的目的是_________________________________________________________。
④下列关于该工艺流程的说法正确的是________(填字母)。
a.该工艺产生的废液含较多的NH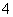 、Na+、Cl-、SO
、Na+、Cl-、SO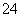
b.Ⅴ中反应时,升高温度一定可以提高SrCO3的生成速率
c.Ⅴ中反应时,加入溶液一定可以提高NH4HCO3的利用率
查看答案和解析>>
科目: 来源: 题型:
已知25 ℃时,难溶化合物的饱和溶液中存在着溶解平衡,例如:AgCl(s)??Ag+(aq)+Cl-(aq),Ag2CrO4(s)??2Ag+(aq)+CrO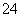 (aq),且Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12。
(aq),且Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12。
(1)若把足量的AgCl分别放入①100 mL蒸馏水,②100 mL 0.1 mol·L-1 NaCl溶液,③100 mL 0.1 mol·L-1 AlCl3溶液,④100 mL 0.1 mol·L-1 MgCl2溶液中,搅拌后在相同温度下Ag+浓度由大到小的顺序是__________________________(填序号)。
(2)现用0.001 mol·L-1 AgNO3溶液滴定0.001 mol·L-1 KCl和0.001 mol·L-1 K2CrO4的混合溶液,试通过计算回答:Cl-和CrO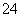 中哪种先沉淀?__________。
中哪种先沉淀?__________。
查看答案和解析>>
科目: 来源: 题型:
已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中c(H+)=1.0×10-13 mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1×10-13 mol·L-1
C.所加烧碱溶液的pH=13.0
D.所得溶液中c(Mg2+)=5.6×10-10 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
粗制的CuSO4·5H2O晶体中含有Fe2+。提纯时,为了除去Fe2+,常加入少量H2O2,然后再加入少量碱至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的。下列说法不正确的是( )
A.溶解CuSO4·5H2O晶体时要加入少量稀H2SO4
B.加入H2O2,将Fe2+氧化,2Fe2++H2O2+2H+===2Fe3++2H2O
C.由于CuSO4的催化作用,会使部分H2O2分解而损失
D.调溶液 pH=4的依据是Cu(OH)2比Fe(OH)3更难溶
查看答案和解析>>
科目: 来源: 题型:
已知某温度下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,当溶液中离子浓度小于10-5mol·L-1时,沉淀就达完全。下列叙述正确的是( )
A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp不变
C.向0.000 8 mol·L-1的K2CrO4溶液中加入等体积的0.002 mol·L-1AgNO3溶液,则CrO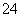 完全沉淀
完全沉淀
D.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液,则先产生AgCl沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com