
科目: 来源: 题型:
室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
| 加入的物质 | 结论 | |
| A | 50mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.05molCaO | 溶液中 |
| C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
| D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
查看答案和解析>>
科目: 来源: 题型:
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A、 铜电极上发生氧化反应
B、 电池工作一段时间后,甲池的c(SO42-)减小
C、 电池工作一段时间后,乙池溶液的总质量增加
D、 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是
A、 Na与H2O的反应是熵增的放热反应,该反应能自发进行
B、 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C、 FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D、 Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目: 来源: 题型:
下列关于物质或离子检验的叙述正确的是
A、 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B、 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C、 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D、 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
查看答案和解析>>
科目: 来源: 题型:
下列有关“化学与生活”的叙述不正确的是
A、 点燃爆竹后,硫燃烧生成SO3
B、 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C、 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒
D、 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱
查看答案和解析>>
科目: 来源: 题型:
某研究小组将纯净的SO2气体通入0.1mol·L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组突出了如下假设:
假设 一:溶液中的NO3-
一:溶液中的NO3-
假设二:溶液中溶解的O2
(1) 验证假设
该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线入下图
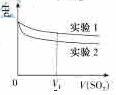
实验1中溶液pH变小的原因是____;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
(2) 验证假设二
请设计实验验证假设二,写出实验步骤,预期现象和结论。
| 实验步骤、预期现象和结论(不要求写具体操作过程) |
(3) 若假设二成立,请预测:在相同条件下,分别通入足量的O2和KNO3,氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反映后两溶液的pH前者_______(填大于或小于)后者,理由是
___________
查看答案和解析>>
科目: 来源: 题型:
硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:

已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原 料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
□NaBO2+□SiO2+□Na+□H2----- --□NaBH4+□Na2SiO3
--□NaBH4+□Na2SiO3
(3)第②步分离采用的方法是______;第③步分离(NaBH4)并回收溶剂,采用的方法是______。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是_______。
查看答案和解析>>
科目: 来源: 题型:
四苯基乙烯(TFE)及其衍生物具有诱导发光特性,在 光电材料等领域应用前景广泛。以下是TFE的两条合成路线(部分试剂及反应条件省略):
光电材料等领域应用前景广泛。以下是TFE的两条合成路线(部分试剂及反应条件省略):
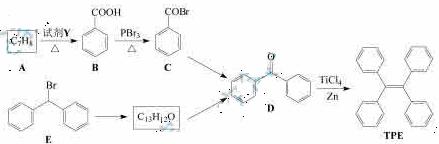
(1)A的名称是______;试剂Y为_____。
(2)B →C的反应类型为_______;B中官能团的名称是______,D中官能团的名称是______.。
→C的反应类型为_______;B中官能团的名称是______,D中官能团的名称是______.。
(3)E→F的化学方程式是_______________________。
(4)W是D的同分异构体,具有下列结构特征:①属于萘(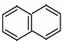 )的一元取代物;②存在羟甲基(-CH2OH)。写出W所有可能的结构简式:_____。
)的一元取代物;②存在羟甲基(-CH2OH)。写出W所有可能的结构简式:_____。
(5)下列叙述正确的是______。
a.B的酸性比苯酚强 b.D不能发生还原反应
c.E含有3种不同化学环境的氢 d.TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目: 来源: 题型:
C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____周期第_____族。
(2)N的基态原子核外电子排布式为_____;Cu的基态原子最外层有___个电子。
(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al_____Si | N____O | 金刚石_____晶体硅 | CH4____SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。
查看答案和解析>>
科目: 来源: 题型:
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是:
A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B.加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D.加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com