
科目: 来源: 题型:
化学与生活、生产、环境等社会实际密切相关。下列叙述正确的是( )
A.稀的食盐水能杀死H7N9禽流感病毒
B.涤纶、塑料、光导纤维都是有机高分子材料
C.用电镀厂的废水直接灌溉农田,可提高水的利用率
D.外形似海绵、密度小、有磁性的碳与石墨互为同素异形体
查看答案和解析>>
科目: 来源: 题型:
资源的回收和合理利用可促进社会的可持续发展。下列说法正确的是( )
A.利用农作物秸杆制取乙醇
B.通过铝热反应回收金属铝
C.回收地沟油,水解制氨基酸
D.直接焚烧废旧塑料,防止白色污染
查看答案和解析>>
科目: 来源: 题型:
2013年11月江苏在大部分地市推广使用含硫量大幅减少的苏V汽油。下列有关汽油的说法正确的是( )
A.汽油属于可再生能源
B.将原油通过萃取、分液可获得汽油
C.使用苏V汽油可降低酸雨发生率
D.苏V汽油只含C、H、O三种元素
查看答案和解析>>
科目: 来源: 题型:
2013年10月世界卫生组织癌症专门机构首次指认大气污染“对人类致癌”。下列行为有利于防止大气污染、遏制雾霾天气发生的是( )
A.在田间焚烧秸杆
B.冬季燃烧大量烟煤供热取暖
C.提倡开私家车出行,减少乘坐公交车
D.改善能源结构,大力发展太阳能、风能等清洁能源
查看答案和解析>>
科目: 来源: 题型:
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是( )
A.减少CO2的排放,可以减少酸雨的产生
B.减少SO2的排放,可以从根本上消除雾霾
C.“天宫一号”使用的碳纤维,是一种新型有机高分子材料
D.用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用
查看答案和解析>>
科目: 来源: 题型:
【定量实验设计】某研究性学习小组查阅资料获得晶体M的制备原理,他们进行如下探究:
【制备晶体】
以CrCl2•4H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了晶体M。
(1)溶液中分离出晶体M的操作包括蒸发浓缩、冷却结晶、过滤、洗涤和干燥。
他们用冰水和饱和食盐水的混合物洗涤晶体M,其目的是 。
制备过程中需要加热,但是,温度过高造成的后果是 。
【测定组成】
为了测定M晶体组成,他们设计如下实验。装置如图所示(加热仪器和固定仪器省略)。
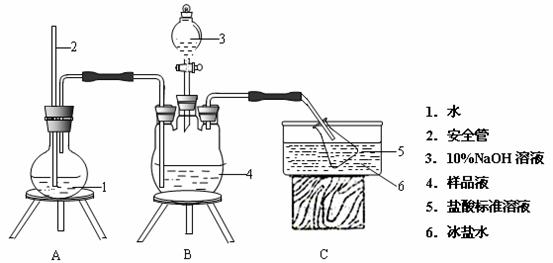
为确定其组成,进行如下实验:
①氨的测定:精确称M晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量20% NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用一定量的盐酸溶液吸收。蒸氨结束后取下接收瓶,用一定浓度的NaOH标准溶液滴定过剩的HCl,到终点时消耗一定体积的 NaOH溶液。
②氯的测定:准确称取a g样品M溶于蒸馏水,配成100 mL溶液。量取25.00 mL配制的溶液用c mol·L1AgNO3标准溶液滴定,滴加3滴0.01 mol·L1K2CrO4溶液(作指示剂),至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色),消耗AgNO3溶液为b mL。
(2)安全管的作用是 。
(3)用氢氧化钠标准溶液滴定过量的氯化氢,部分操作步骤是检查滴定管是否漏液、用蒸馏水洗涤、 、排滴定管尖嘴的气泡、 、滴定、读数、记录并处理数据;下列操作或情况会使测定样品中NH3的质量分数偏高的是 (填代号)。
A.装置气密性不好 B.用酚酞作指示剂
C.滴定终点时俯视读数 D.滴定时NaOH溶液外溅
(4)已知:硝酸银热稳定性差;Ksp(Ag2CrO4)=1.12×1012,Ksp(AgCl)=1.8×1010
选择棕色滴定管盛装标准浓度的硝酸银溶液,滴定终点时,若溶液中
c(CrO42)为2.8×103 mol·L1,则c(Ag+)= 。
(5)根据上述实验数据,列出样品M中氯元素质量分数计算式 。
如果滴加K2CrO4溶液过多,测得结果会 (填:偏高、偏低或无影响)。
(6)经测定,晶体M中铬、氨和氯的质量之比为104∶136∶213。写出制备M晶体的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
某兴趣小组拟制备氯气并验证其一系列性质。
Ⅰ.【查阅资料】
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色。
②硫代硫酸钠溶液在工业上可作为脱氯剂 。
Ⅱ.【性质验证】
实验装置如图所示(省略夹持装置)
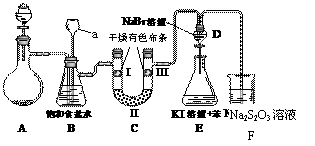

实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是 ;装置CⅡ处加的试剂可以是 (选填下列字母编号)。
A.碱石灰 B.硅胶 C.浓硫酸 D.无水氯化钙
(2)装置B的作用有 。
(3)写出装置F中相应的离子反应方程式: 。
Ⅲ.【探究与反思】
 (1)上图中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的,其理由是 。该组的同学思考后将上述D、E、F装置改为实验操作步骤如下:
(1)上图中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的,其理由是 。该组的同学思考后将上述D、E、F装置改为实验操作步骤如下:
①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹。
③当a中溶液由黄色变为棕色时,停止通氯气。
④___。
(2)设计步骤③的实验思想是 。
(3)步骤④的操作是 。
查看答案和解析>>
科目: 来源: 题型:
草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:
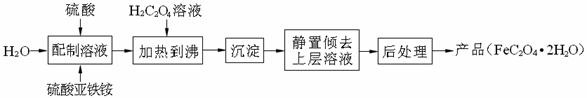
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加少量硫酸,目的是 。
(2)沉淀时发生反应的化学方程式为_____________________________________________________。
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成。这说明草酸亚铁晶体具有_________(填“氧化”或“还原”)性。若反应中消耗1mol FeC2O4·2H2O,则参加反应的n(KMnO4)为__________。
(4)三草酸合铁酸钾晶体K3[Fe(C3O4 )3]·3H2O
(5)称取3.60g草酸亚铁晶体(摩尔质量是180g·mol-1)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:
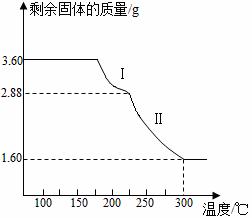
①过程Ⅰ发生反应的化学方程式为 。
②300℃时剩余固体是铁的一种氧化物,试通过计算确定该氧化物的化学式 (写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:① Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
② C(s,石墨)+CO2(g)=2CO(g) ΔH 2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
① 该反应的平衡常数表达式为K= 。
② 取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH (填“>”、“<”或“=”,下同)0。
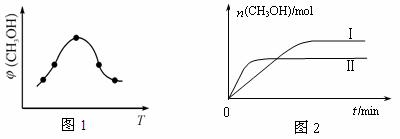
③ 在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ KⅡ。
(3)以CO2为原料还可以合成多种物质。
① 工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。开始以氨碳比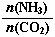 =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
② 用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
③ 将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Ka=4.3×10-7,则NH4HCO3溶液呈 (填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
科目: 来源: 题型:
磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是实验室常见试剂。
已知: SO2Cl2(g) SO2(g) + Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO2(g) + Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO₂(g) +Cl₂(g)+ SCl₂(g) 2SOCl₂(g) K2 △H=b kJ/mol (Ⅱ)
2SOCl₂(g) K2 △H=b kJ/mol (Ⅱ)
(1)反应:SO2Cl2(g)+ SCl₂(g)  2SOCl2(g)的平衡常数K = (用K1、K2表示),该反应
2SOCl2(g)的平衡常数K = (用K1、K2表示),该反应
△H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(Ⅰ)的影响,以13.5 g SO2Cl2充入2.0L的烧瓶中,在101kPa 375K时,10min达到平衡,平衡时SO2Cl2转化率为0.80,则0~10minCl2的平衡反应速率为 ,平衡时容器内压强为 kPa,该温度的平衡常数为 ;若要减小SO2Cl2转化率,除改变温度外,还可采取的措施是 (列举一种)。
(3)磺酰氯对眼和上呼吸道粘膜有强烈的刺激性,发生泄漏时,实验室可用足量NaOH固体吸收,发生反应的化学方程式为 ;亚硫酰氯溶于水的离子方程式为 。
(4)一定量的Cl2用稀NaOH溶液吸收,若恰好反应,则溶液中各离子浓度由大到小的顺序为 ;
已知常温时次氯酸的Ka=2.5×10-8则该温度下NaClO水解反应的平衡常数
Kb= mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com