
科目: 来源: 题型:
根据下表所列电离能I/kJ·mol-1的数据,下列判断中错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
A.元素X和Y可能是同周期元素
B.元素X不可能是ⅡA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.元素Y在化学性质上与锡相似
查看答案和解析>>
科目: 来源: 题型:
沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=________mol·L-1。
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是__________________________________________________。
(用沉淀溶解平衡原理解释)。万一误服了少量BaCO3,应尽快用大量0.5 mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol·L-1。
(3)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为:
__________________________________________________;
②请分析CaSO4转化为CaCO3的原理:_________________________________________
__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
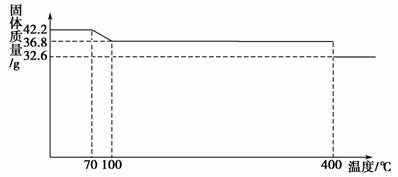
试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_________________________________ _____________________________________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在25 ℃时,将a mol·L-1的KCN溶液与0.01 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a________0.01 mol·L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____________________________________________________________。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O===2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O,则另一个反应的离子方程式为____________________________________________________________。
上述转化的重要意义在于__________________________________ ______________________________________。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全________ _______________________________________________________________。
(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目: 来源: 题型:
下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
| 冷轧含锌 废水水质 | 经处理后的水国 家环保标准值 | |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO | ≤23 000 | ≤150 |
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为____________mg·
L-1(常温下,Ksp[Zn(OH)2]=1.2×10-17),________(填“符合”或“不符合”)国家环保标准。
查看答案和解析>>
科目: 来源: 题型:
已知H2A在水中存在以下平衡:H2AH++HA-,HA-H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是___________________________________________ _______________________________________________________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下所示关系一定正确的是________。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是__________________________ _____________________________________________________________________________________________(用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。则原溶液中c(I-)/c(Cl-)的比值为 ( )。
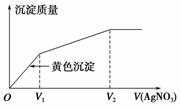
A.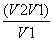 B.
B.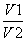
C.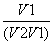 D.
D.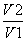
查看答案和解析>>
科目: 来源: 题型:
已知常温下Ksp(AgCl)=1.8×10-10mol2/L2;Ksp(AgI)=1.0×10-16mol2/L2。下列说法中正确的是( )
A.在相同温度下AgCl的溶解度小于AgI的溶解度
B.AgCl和AgI都不溶于水,因此AgCl和AgI不能相互转化
C.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于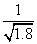 ×10-11mol·L-1
×10-11mol·L-1
D.将足量的AgCl分别放入下列物质中:①20 mL 0.01 mol·L-1KCl溶液,②10 mL 0.02 mol·L-1CaCl2溶液,③30 mL 0.05 mol·L-1AgNO3溶液,AgCl的溶解度由大到小的顺序为③>②>①
查看答案和解析>>
科目: 来源: 题型:
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl
的Ksp=4×10-10,下列说法不正确的是( )
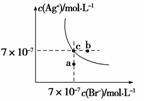
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
 D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816
D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com