
科目: 来源: 题型:
在2 L的密闭容器中,发生以下反应:2A(g) + B(g) 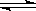 2C(g) + D(g)。若最初加入的A和B都是3 mol,在前10 s A的化学反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g) + D(g)。若最初加入的A和B都是3 mol,在前10 s A的化学反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.0.6 mol B.1.2 mol C.2.4 mol D.1.8 mol
查看答案和解析>>
科目: 来源: 题型:
已知C(石墨,s) = C(金刚石,s) △H>0,
P(白磷,s) = P(红磷,s) △H<0。根据上述信息推论正确的是( )
A.前者为放热反应 B.红磷的能量比白磷低
C.红磷比金刚石稳定 D.上述变化都为物理变化
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.活化分子间所发生的碰撞为有效碰撞
B.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数
D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大
查看答案和解析>>
科目: 来源: 题型:
氢能是一种既高效又清洁的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
①原料来源广;②易燃烧、热值高;③储存方便;④制备工艺廉价易行
A.③④ B.①② C.①③ D.②④
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.化学反应一定伴随有热量的变化
B.活化能越大的化学反应其反应热数值也越大
C.反应热的产生是由于生成物与反应物的总能量不同
D.放热反应是由于反应物键能总和大于生成物键能总和
查看答案和解析>>
科目: 来源: 题型:
下列物质属于强电解质且能导电的是( )
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH
⑥稀硫酸 ⑦乙酸
A.⑤ B.①②⑥ C.②⑤⑥⑦ D.①③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
往一个容积为5L的密闭容器中,通入2molN2和3molH2,在一定条件下,发生反应 N2+3H2 2NH3,2 min后测得容器中生成了1mol NH3,试求:
2NH3,2 min后测得容器中生成了1mol NH3,试求:
(1)2 min时,N2的物质的量 ;
(2) 2 min时,H2的物质的量浓度 ;
(3)2 min时,H2的转化率 ;
(4)2min内,N2的平均反应速率 ;
查看答案和解析>>
科目: 来源: 题型:
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M与X同主族,与W同周期。
(1)M元素是________(填元素符号)。
(2)Z、W形成的气态氢化物的稳定性为 > (填化学式)。
(3)M2Z2的电子式为________________,写出M2Z2与水反应的离子方程式:
。
(4)由X、Y、Z、W四种元素中的三种组成的—种强酸,该强酸的稀溶液能与铜反应,离子方程式为__________________________________________。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知:
①1 mol A能与足量NaOH浓溶液反应生成标准状况下44.8 L气体;
②A能与盐酸反应产生气体B,该气体能与氯水反应。
则A是____________(填化学式);写出该气体B与氯水反应的离子方程式:_______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响,能表明同一规律的实验还有 (填实验序号);
(2)本实验中影响反应速率的除了浓度还有 ,仅表明该因素对反应速率产生影响的实验有 (填实验序号)。
(3)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
。
查看答案和解析>>
科目: 来源: 题型:
有X、Y、Z、M 、N按原子序数依次递增的五种短周期元素,其中Z、M、N同周期,X、 Z同主族且X是原子半径最小的原子;Y、N同主族,Z+与Y2—具有相同的电子层结构;M的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1)M的元素名称 ,N在元素周期表中的位置 。
(2)离子半径比较:r(Z+) r(Y2—)。(填“>”、“=”或“<”)
(3)X与Z形成的化合物A是 (填“离子化合物”或“共价化合物”),A与X2Y反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com