
科目: 来源: 题型:
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=-Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=-Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
查看答案和解析>>
科目: 来源: 题型:
下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A.C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(g);ΔH=-akJ·mol-1
6CO2(g)+6H2O(g);ΔH=-akJ·mol-1
B.CH3CH2OH(l)+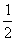 O2(g)
O2(g) CH3CHO(l)+H2O(l);ΔH=-bkJ·mol-1
CH3CHO(l)+H2O(l);ΔH=-bkJ·mol-1
C.CO(g)+ 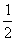 O2(g)
O2(g)
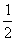 CO2(g);ΔH=-c kJ·mol-1
CO2(g);ΔH=-c kJ·mol-1
D.NH3(g)+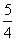 O2(g)
O2(g) NO(g)+
NO(g)+ H2O(g);ΔH=-d kJ·mol-1
H2O(g);ΔH=-d kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石。已知把石墨完全转化为金刚石时,要吸收能量,下列说法正确的是( )
A.石墨不如金刚石稳定
B.金刚石与石墨一样稳定
C.等质量的金刚石与石墨完全燃烧,放出的能量一样多
D.等质量的金刚石与石墨完全燃烧,石墨放出的能量少
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,10L密闭容器中加入5molSO2、4.5molO2,经10min后反应达平衡时有3molSO2发生了反应。
(1)O2的转化率为多少? (计算结果保留小数点后一位数字)
(2)平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)
(3)平衡时体系中SO3的百分含量(体积分数)为多少?(计算结果保留小数点后一位数字)
查看答案和解析>>
科目: 来源: 题型:
NH3(g)燃烧的方程式为4NH3(g) + 7O2(g) ==4NO2(g) +6H2O(g),已知:
(1)2H2(g)+O2(g) == 2H2O(g) △H= - 483.6 kJ/mol
(2)N2(g)+ 2O2(g) == 2NO2 (g) △H= + 67.8 kJ/mol
(3) N2(g)+ 3H2(g) == 2NH3 (g) △H= - 92.0 kJ/mol
试计算NH3 (g)的燃烧热。(计算结果保留小数点后一位数字)
查看答案和解析>>
科目: 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
查看答案和解析>>
科目: 来源: 题型:
(1)对于下列反应:2SO2(g) + O2(g) 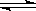 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
(2)下图表示在密闭容器中反应:2SO2+O2 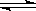 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处。
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处。
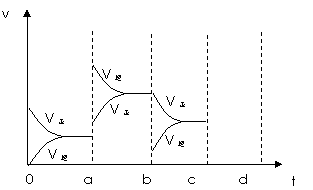 |
(3)以上反应达平衡后,
若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应正向为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均相对分子质量
比原平衡时 (填“增大”、“减小”或“相等”)。
查看答案和解析>>
科目: 来源: 题型:
城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭和水蒸气反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式_______________________________。
(2)液化石油气的主要成分是丙烷,已知丙烷、CO以及氢气燃烧的热化学方程式分别为:
C3H8(g) +5O2(g) == 3CO2(g) + 4H2O(l) △H= –2220.0 kJ·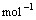
CO(g) +1/2O2(g) == CO2(g) △H= –282.6kJ·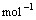
2H2(g)+O2(g) == 2H2O(l) △H= –571.6 kJ·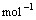
试比较同物质的量的C3H8和CO燃烧,产生的热量比值约为______________;
同质量的H2和C3H8燃烧,产生的热量比值约为________________。(计算结果保留小数点后一位数字)
(3)氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用。请在下图的两个空框中填上循环过程中的反应物和生成物,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转换的角度看,过程II主要是_______能转化为________能。
 |
查看答案和解析>>
科目: 来源: 题型:
(1)已知:重铬酸根离子(Cr2O72—)是橙红色的,铬酸根离子(CrO42-)是黄色的,重铬酸钾溶于水发生反应:Cr2O72-+H2O 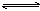 2CrO42-+2H+,溶液为橙黄色,向溶液中滴加少量6mol/L的硫酸,溶液呈________色,原因是
2CrO42-+2H+,溶液为橙黄色,向溶液中滴加少量6mol/L的硫酸,溶液呈________色,原因是
。
 (2)已知:2NO2 N2O4 ΔH= -56.9kJ/mol。一定条件下,将该混合体系置于一个带活塞的体积可变的密闭容器中,推动活塞以减小容器的体积,此时的现象是________________________________,原因是_________________________。
(2)已知:2NO2 N2O4 ΔH= -56.9kJ/mol。一定条件下,将该混合体系置于一个带活塞的体积可变的密闭容器中,推动活塞以减小容器的体积,此时的现象是________________________________,原因是_________________________。
(3)将NO2和N2O4混合气体置于恒容密闭容器中,将该体系升温至100oC,此时的现象是_________________________,原因是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com