
科目: 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是
A.生成物能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g) + Cl2(g) = 2 HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目: 来源: 题型:
有关化学反应的说法中,正确的是
A.自发反应都是放热反应
B.自发反应 都是熵增大的反应
都是熵增大的反应
C.能自发进行的吸热反应一定是熵增大的反应
D.非自发反应在任何条件下都不能实现
查看答案和解析>>
科目: 来源: 题型:
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2 (g) + 3 H2(g)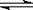 2NH3(g)
2NH3(g)
(1)若反应到达某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)
为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),
n(始)∶n(平) = 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
查看答案和解析>>
科目: 来源: 题型:
在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:
SO2(g)+ NO2(g) 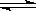 SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
试求:该温度下、该容器中,再继续加入1mol的SO2(g),则:
(1)化学平衡将向________方向移动,NO2的转化率将____________;
(2)经计算,当达到新的平衡状态时,容器中SO2(g)的浓度是_______mol/L;
(3)整个过程中,SO2的转化率由50%变为_______%,NO2的转化率由__________%变为_______%。
(4)计算结果给我们的启示是:增大一种反应物物的用量,其转化率将________________(填“增大” 、“不变”或“减小”)另一反应物的转化率将____________(填“增大” 、“不变”或“减小”)。现实生产中的意义是:可以通过增大________的用量,来提高成本高的反应物的利用率。
查看答案和解析>>
科目: 来源: 题型:
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:
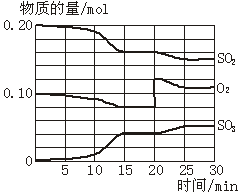 |
(1)降低温度,SO2的转化率_________,化学反应速率_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是_____ ____。
(3)反应进行至20 min时,曲线发生变化的原因是_____________________ _(用文字表达)。
10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
查看答案和解析>>
科目: 来源: 题型:
简答:
在水溶液中,橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72- + H2O 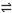 2CrO42- + 2H+ 把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
2CrO42- + 2H+ 把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1) 向上述溶液中加入NaOH溶液,溶液呈_________色,因为______________________
__________________________________________________________________。
(2) 向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈_________色,因为
_____________________ 。
(3) 向原溶液中逐滴加入Ba(NO3)2 溶液(已知BaCrO4为黄色沉淀),则平衡_______ ,溶液颜色将_______________ 。
(4)已知Cr2O72-与 I- 在酸性条件下可发生氧化还原反应:
Cr2O72--+ 16I- + 14 H+= 2Cr3++ 3 I 2+ 7 H2O
此反应中的氧化产物是_____,当消耗0.1 mol K2Cr2O7时,共有_________mol电子转移。
查看答案和解析>>
科目: 来源: 题型:
为了完成教材上的“中和热的测定”这个实验
(1)实验桌上有烧杯(大、小两个)、泡沫橡胶、泡沫塑料板、环形玻璃搅拌器,0.5mol·L-1盐酸、0.55mol·L—1NaOH溶液,尚缺少的实验用品是 。
(2)实验中能否用环形铜丝搅拌器代替环形玻璃搅拌器?答: (填“能”或“否”)。其原因是 。
(3) 实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g·cm—3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式: 。
(4)在下列仪器选择时,不是为了避免测量误差的是 。
A.两个烧杯 B.两个量筒 C.温度计 D.塑料盖板 E.泡沫塑料
查看答案和解析>>
科目: 来源: 题型:
氢气是一种清洁能源。
(1)已知 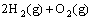 =2H2O(g) △H=- 483.6 kJ/mol
=2H2O(g) △H=- 483.6 kJ/mol
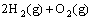 =2H2O(l) △H=-571.6 kJ/mol
=2H2O(l) △H=-571.6 kJ/mol
 |
=H2O(l) △H=-285.8 kJ/mol
氢气的燃烧热是 kJ/mol
(2)人们可以通过多种途径获取氢气。
①1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为
②工业上制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g),已知在25℃时:
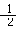 H2 (g) + O2 (g) = H2O(g) △H=-242 kJ/mol
H2 (g) + O2 (g) = H2O(g) △H=-242 kJ/mol
C(石墨)+O2(g)== CO2(g) △H=-394 kJ/mol
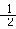 C(石墨)+ O2(g)== CO(g) △H=-111 kJ/mol
C(石墨)+ O2(g)== CO(g) △H=-111 kJ/mol
则25℃时一氧化碳与水蒸气作用转化成氢气和二氧化碳反应的△H= kJ/mol 。
查看答案和解析>>
科目: 来源: 题型:
对于平衡体系mA(气)+nB(气) PC(气)十qD(气) △H <0,有下列判断,其中正确的是
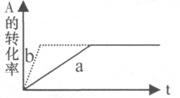 A.若温度不变,将容器的体积缩小1倍,此时A的浓度变为原来的1 .8倍,则m+n<p+q
A.若温度不变,将容器的体积缩小1倍,此时A的浓度变为原来的1 .8倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时A,B的物质的量之比为m:n
C.若平衡体系共有气体amol,再向其中加人bmolB,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n>p+q
D.加催化剂或增大压强,可实现右图a→b的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com