
科目: 来源: 题型:
下列有关σ键和π键的说法错误的是 ( )。
A.在某些分子中,化学键可能只有π键而没有σ键
B.当原子形成分子时,首先形成σ键,可能形成π键,配位键都是σ键
C.σ键的特征是轴对称,π键的特征是镜面对称
D.含有π键的分子在反应时,π键是化学反应的积极参与者
查看答案和解析>>
科目: 来源: 题型:
下列关于SO2与CO2分子的说法正确的是( )
A.都是直线形结构
B.中心原子都采取sp杂化
C.S原子和C原子上都没有孤对电 子
子
D.SO2为V形结构,CO2为直线形结构
查看答案和解析>>
科目: 来源: 题型:
(Ⅰ)硫、碳、硅是三种重要的非金属元素,请回答下列问题:
(1)它们的非金属性由强到弱的顺序是 (用元素符号表示),
| |
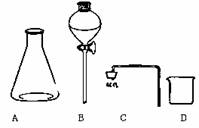
(2)请你用题中所给仪器设计一套装置证明(1)中的结论,在右边方框
中画出装置图;仪器B的名称是 。
(3)实验过程中在仪器B 中应装入的试剂是 ,烧杯中出现的现
象是 。若锥形瓶中装的是一种能溶于水的正盐,则
其中发生反应的离子方程式为 。
| |
(1)在右边方框中画出装置图。
(2)若实验时,M上有气泡,N上没气泡,则M的最高价氧化物对应
的水化物的碱性比N的最高价氧化物对应的水化物的碱性比
(填“强”或“弱”),外电路中电子由 (填M或N)极流
向 (填M或N)极。
查看答案和解析>>
科目: 来源: 题型:
下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ)。
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 | 366 | 298 |
根据上述数据回答(1)~(4)题:
(1)下列物质本身具有的能量最高的是________ (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是________ (填A.B.C.D),若无上表中的数据,你能正确回答出此问题吗?_____(填能、否)你的根据是__________________________________。
A.HF B.HCl C.HBr D.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是________反应(填“吸热”或“放热”)
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是____________(填写分子式)。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E是原子序数由小到大排列的五种短周期元素,其中B、C、D的原子序数之和为31,A是元素周期表中原子半径最小的元素,B、C左右相邻,C、D位于同主族.
(1)E元素原子的结构示意图为: ,写出一个能证明D、E两元素非金属性强弱的反应方程式: .
(2)用电子式表示A与B形成含10个电子的分子的过程 ,其中含有的化学键为 (填“极性键”“非极性键”“离子键”).
(3)A、B、C、D四种元素中的三种能组成一种强酸,该强酸的稀溶液能与铜反应,其中起酸性作用的酸占消耗酸总物质的量的百分比是 .
(4)由A、B、C、D四种元素组成的一种离子化合物X.
①已知1mol X能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下X与NaOH浓溶液反应的离子方程式: .
②又知X既能与E和A形成的化合物反应,又能与E形成的单质的水溶液起反应,写出X的化学式: .
(5)A、B、C、D和Fe五种元素组成相对分子质量为392的化合物Y,1mol Y中含有6mol结晶水.对化合物Y进行如下实验:
a.取Y的 溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味的气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色.
b.另取Y的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
①Y的化学式为 .
②写出Y与足量Ba(OH)2溶液反应的离子方程式: .
查看答案和解析>>
科目: 来源: 题型:
已知反应4NH3(g)+5 O2 (g) 4NO (g)+6H2O (g)。回答下列问题:
4NO (g)+6H2O (g)。回答下列问题:
(1)在一定温度下,向一个5 L的密闭容器中充入0.20 mol的NH3和0.80 mol的O2,如反应初始6min内NH3的平均反应速率v(NH3)=0.003 mol·L-1·min-1,则6 min时c(O2)=___mol·L-1,NO的物质的量为________mol;反应一段时间后,达到平衡状态,如果这时向该密闭容器中再充入1 mol氩气,平衡时NH3的转化率________。(填“增大”“不变”或“减小”)
(2)判断该反应是否达到平衡的依据为________(填正确选项前的字母):a.体系压强不随时间改变 b.气体的密度不随时间改变 c.c(NH3)不随时间改变 d.单位时间里生成NO和H2O (g)的物质的量之比为4:6
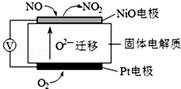 (3)氮的氧化物NOx是大气污染的主要污染物之一,通过NOx传感器可监测NOx的含量,其工作原理示意图如右:(工作原理和燃料电池类似)①Pt电极为 极(填正、负);NiO电极发生 反应(填“氧化”或“还原”).
(3)氮的氧化物NOx是大气污染的主要污染物之一,通过NOx传感器可监测NOx的含量,其工作原理示意图如右:(工作原理和燃料电池类似)①Pt电极为 极(填正、负);NiO电极发生 反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式: .
查看答案和解析>>
科目: 来源: 题型:
下表是周期表的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答问题:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的是 _________ ,只有负价而无正价的是 _________ ,可用于制半导体材料的元素是 _________ .
(2)最高价氧化物的水化物碱性最强的物质的电子式是 _________ ,酸性最强的物质是 _________ ,呈两性的物质是 _________ ;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物是 _________ ;
(4)B元素与A形成的化合物和水反应后溶液呈碱性,同时生成一种可燃气体,写出反应的化学方程式 _________ .
查看答案和解析>>
科目: 来源: 题型:
下列有关粒子半径的叙述正确的是
A、电子层结构相同的粒子随核电荷的递增半径逐渐增大
B、CsCl、NaBr、CaF2、LiI四种化合物中LiI的阴阳离子半径之比值最大
C、S2-半径小于硫原子半径
D、无法比较K+、Al3+ 、O2- 、Cl-的半径大小
查看答案和解析>>
科目: 来源: 题型:
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A、常压下五种元素的单质中,Z单质的沸点最高
B、Y、Z的阴离子电子层结构都与R原子的相同
C、W的氢化物的沸点比X的氢化物的沸点高
D、Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com