
科目: 来源: 题型:
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g)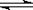 2NH3(g)
2NH3(g)
(1)若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)
为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),
n(始)∶n(平) = 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
查看答案和解析>>
科目: 来源: 题型:
向某一容积为5 L的密闭容器中,加入 0.2 mol CO和0.2 mol H2O,在800℃和催化剂存在的条件下,发生如下反应:CO(g)+H2O(g) 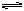 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
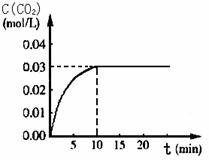
(1)由图中数据可知,反应从开始至达到平衡时,CO的化学反应速率v(CO)= ; H2的物质的量浓度c(H2)=_____________;该温度下此反应的平衡常数K = 。
(2)判断该反应是否达到平衡状态的依据是________________(填序号)。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为0
(3)若开始时向该容器中加入CO、H2O(g)、CO2和H2各0.1 mol,在相同条件下,反应达到平衡时,水蒸气的物质的量浓度c(H2O)=_______________。
查看答案和解析>>
科目: 来源: 题型:
某学生在实验室分别取50 mL0.50 mol/L盐酸和50 mL0.55 mol/LNaOH溶液用下图所示装置进行测定中和热的实验,并将实验数据记录如下:
| 实验次数 | 起始温度t1/℃ |
t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
请回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 。
(2)经数据处理,t2-t1= 3.4 ℃。则该实验测得的中和热ΔH = _
(3)假定该学生的操作完全同上,实验中改用100 mL 0.50 mol/L盐酸跟100 mL
0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
查看答案和解析>>
科目: 来源: 题型:
氢气是一种清洁能源。
(1)已知 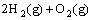 =2H2O(g) △H=- 483.6 kJ/mol
=2H2O(g) △H=- 483.6 kJ/mol
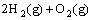 =2H2O(l) △H=-571.6 kJ/mol
=2H2O(l) △H=-571.6 kJ/mol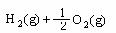
=H2O(l) △H=-285.8 kJ/mol
氢气的燃烧热是 kJ/mol
(2)人们可以通过多种途径获取氢气。
①1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为
②工业上制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g),已知在25℃时:
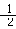 H2 (g) + O2 (g) = H2O(g) △H=-242 kJ/mol
H2 (g) + O2 (g) = H2O(g) △H=-242 kJ/mol
C(石墨)+O2(g)== CO2(g) △H=-394 kJ/mol
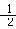 C(石墨)+ O2(g)== CO(g) △H=-111 kJ/mol
C(石墨)+ O2(g)== CO(g) △H=-111 kJ/mol
则25℃时一氧化碳与水蒸气作用转化成氢气和二氧化碳反应的△H= kJ/mol 。
查看答案和解析>>
科目: 来源: 题型:
下表是元素周期表中短周期部分,表中所列字母分别代表一种元素。
| A | |||||||
| B | C | D | E | ||||
| F | G | H |
根据上述元素回答问题:(本题用化学用语回答)
(1)上述元素中地壳中极为丰富的元素 ,单质中熔点最高的可能是 ,
E、F、G离子半径由小到大的顺序是 写出化合物A2D2的电子式
(2)A、B、D、F四种元素组成的受热易分解的化合物,写出少量该化合物溶液与足量
Ba(OH)2溶液反应的离子方程式 。
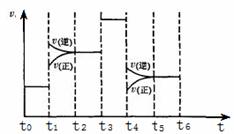 (3)化学反应3A2 (g)+C2 (g)
(3)化学反应3A2 (g)+C2 (g)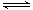 2CA3 (g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图中表示反应速率与反应过程的关系,其中表示平衡混合物中CA3含量最高的一段时间是 。温度为T℃时,将4mol A2和2mol C2放入1L密闭容器中,60s后测得C2的转化率为50%,则A2的反应速率
2CA3 (g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图中表示反应速率与反应过程的关系,其中表示平衡混合物中CA3含量最高的一段时间是 。温度为T℃时,将4mol A2和2mol C2放入1L密闭容器中,60s后测得C2的转化率为50%,则A2的反应速率
为 。
查看答案和解析>>
科目: 来源: 题型:
简答:
在水溶液中,橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72- + H2O 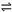 2CrO42- + 2H+ 把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
2CrO42- + 2H+ 把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1) 向上述溶液中加入NaOH溶液,溶液呈_________色,因为______________________
__________________________________________________________________。
(2) 向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈_________色,因为
_____________________ 。
(3) 向原溶液中逐滴加入Ba(NO3)2 溶液(已知BaCrO4为黄色沉淀),则平衡_______ ,溶液颜色将_______________ 。
(4)已知Cr2O72-与 I- 在酸性条件下可发生氧化还原反应:
① 配平反应的离子方程式
Cr2O72--+ I-+ H+= Cr3++ I 2+ H2O
② 此反应中的氧化产物是_____,当消耗0.1 mol K2Cr2O7时,共有_________mol电子转移。
查看答案和解析>>
科目: 来源: 题型:
已知在密闭容器中发生的反应:H2(g)+ I2(g) 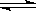 2 HI(g) △H<0 。若改变下列条件,则其反应速率发生的变化是(在表格的相应空格内填“√”)
2 HI(g) △H<0 。若改变下列条件,则其反应速率发生的变化是(在表格的相应空格内填“√”)
| 序号 | 改变条件 | 反应速率变化 | ||
| 增大 | 减小 | 不变 | ||
| (1) | 升高温度 | |||
| (2) | 充入更多的H2 | |||
| (3) | 扩大容器的体积 | |||
| (4) | 定容充入氦气 |
查看答案和解析>>
科目: 来源: 题型:
已知热化学方程式2C2H2 (g) + 5O2 (g)= 4CO2 (g) +2H2O (g) ΔH= -1256 kJ/mol,下列说法正确的是
A.乙炔的燃烧热为1256 kJ /mol
B.若转移10 mol电子,则消耗2.5 mol O2
C.若生成2 mol 液态水,则ΔH = -1256 kJ/mol
D.若形成4 mol碳氧共用电子对,则放出的热量为1256 kJ
查看答案和解析>>
科目: 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4 (g)+2H2 (g)=Si (s)+4HCl (g) 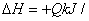 mol(Q>0)
mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L, 则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com