
科目: 来源: 题型:
阿司匹林能迅速解热、镇痛。长效缓释阿司匹林可在体内逐步水解而疗效更佳。用丙酮为主要原料合成长效缓释阿司匹林的流程如下图。已知:,回答下列问题:

(1)B含有的官能团的名称是_______,反应的反应类型为_______
(2)下列有关阿司匹林的叙述正确的是_______
A.属于芳香烃
B.分子式为C9H10O4
C.能与NaHCO3溶液反应生成无色气体
D.在酸性条件下水解生成的产物之一可使溶液显紫色
(3)D的结构简式_______
(4)写出B→C反应的化学方程式__________________
(5)有机物A是阿司匹林的同分异构体,具有如下特征:①苯环含有对二取代结构②能发生银镜反应③能发生水解反应且产物中的2种为同系物或同种物质。写出A的结构简式_______(只写一种)
查看答案和解析>>
科目: 来源: 题型:
元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系。
(1)第二周期元素碳、氮、氧的电负性从大到小顺序为 (用元素符号表示)。
(2)第四周期元素砷、硒、溴的第一电离能从大到小顺序为
(用元素符号表示)。
(3)第 IIIA族元素原子具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质。
①[B(OH)4]-中B的原子杂化类型为 ;
②不考虑空间构型,[B(OH)4]-的结构可用示意图表示为 。
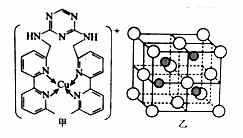 (4)过渡区元素铜的离子是人体内多种酶的辅因子。某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子:
(4)过渡区元素铜的离子是人体内多种酶的辅因子。某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子:
①写出Cu(Ⅰ)的电子排布式 ;
②该离子中含有化学键的类型有 (选填字母)。
A.极性键 B.离子键 C.非极性键 D.配位键
③向氯化铜溶液中通入足量的二氧化硫,生成白色沉
淀M,M的晶胞结构如图乙所示。写出该反应的
离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。
已知:①过碳酸钠具有Na2CO3和H2O2的性质。
②2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
③50 °C时 2Na2CO3·3H2O2 (s) 开始分解
某兴趣小组制备过碳酸钠的装置示意图如下:
 |
请回答下列问题:
(1)图中玻璃导管a的作用是
(2)本实验的关键是控制温度,用该装置制备过碳酸钠有不足之处,下列改进措施可行的是 (填序号)。
A、缓慢滴加H2O2溶液 B、冷水浴 C、用酒精灯加热
(3)将实验改进后按以下流程可获得过碳酸钠产品

①洗涤固体Y时选用无水乙醇作为洗涤剂的目的是
②在滤液X中加入适量中加入适量NaCl固体可析出过碳酸钠,原因是
(4)下列物质中,会引起过碳酸钠失效的有 。
A.Na2S B.FeCl3 C.Na2SiO3 D.NaHCO3
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取m1g样品→溶解→沉淀反应→ 过滤过滤
→ 洗涤洗涤
→ 干燥干燥
→ 称量m2g。
①写出沉淀反应的离子方程式______________________________________
②产品中过碳酸钠质量分数的表达式为: 。
③结果与分析:
查看答案和解析>>
科目: 来源: 题型:
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
已知:①NiCl2易溶水,Fe3+不能氧化Ni2+
②该温度下一些难溶物的Ksp及沉淀析出的理论pH如下表所示:
| Ksp | 开始沉淀pH | 沉淀完全pH |
| |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 | |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 | |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 | |
| NiC2O4 | 4.0×10-10 | —— | —— |
回答下列问题:
(1)该工艺流程中多次重复利用的一种实验基本操作是 。
(2)步骤①所留残渣的主要成分为 (填物质名称)
(3)根据上表数据判断步骤②依次析出沉淀Ⅱ______和沉淀Ⅲ______(填化学式),
控制两种沉淀析出可利用 。
A.pH试纸 B.石蕊指示剂 C.pH计
(4)已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则步骤③的化学反应方程式是 。
(5)C可被E氧化,写出步骤④的离子反应方程式 。
(6)FeCl3和AlCl3 的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则c(Fe3+)/c(Al3+)= 。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、W为中学化学常见的物质,它们之间的转化关系如图所示:
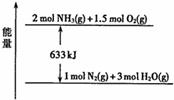
请填写下列空白。
Ⅰ.若X是酸式盐,Z是NH3.且常温下0.1mol/LX溶液pH≈1
(1)X→Y的离子方程式是 。
(2)X溶液中各种离子浓度由大到小的顺序为 。
(3)820℃时,一定量NH3和O2反应生成NO和H2O。若该反应
消耗0.20mol NH3,放出热量45.3kJ,结合如图所示能量关系,
写出N2与O2反应生成NO的热化学方程式: 。
Ⅱ.若X是酸,W是一种常见的金属单质
(4)Y→Z的离子方程式是 。
(5)工业上冶炼金属W的原理 。(用化学方程式表示)
(6)食品包装中常见的脱氧剂组成为W粉末、NaCl、炭粉等,其脱氧过程实质上发生了电化学腐蚀,则负极的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
下列有关说法正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
C.加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大
D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目: 来源: 题型:
现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
A.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11
B.由水电离出的c(H+):①=②=③=④
C.分别加水稀释10倍、四种溶液的pH:①>②>③>④
D.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
查看答案和解析>>
科目: 来源: 题型:
下列实验操作与预期实验目的或实验结论一致的是( )
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 测同浓度的Na2CO3、CH3COONa 溶液的PH值前者大 | 酸性强弱:CH3COOH 比H2CO3强 |
| B | 向某溶液加入盐酸酸化的氯化钡溶液有沉淀产生 | 说明此溶液中一定含SO42‾ |
| C | 向Na2SiO3溶液中通入CO2 出现浑浊 | 非金属性强弱:C>Si |
| D | 比较H2O和H2S的沸点前者大 | 非金属性:O>S |
查看答案和解析>>
科目: 来源: 题型:
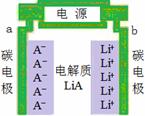
正、负极都是碳材料的双碳性电池,电池充、放电过程为2nC+LiA  CnA+LiCn,充电时Li+、A-分别吸附在两极上形成LiCn和CnA(如图所示),下列说法正确的是( )
CnA+LiCn,充电时Li+、A-分别吸附在两极上形成LiCn和CnA(如图所示),下列说法正确的是( )
A.a是电池的负极
B.放电时,A-离子向b极移动
C.放电时,负极的电极反应式是nC-e-+A-= CnA
D.充电时,电解质中的离子浓度保持不变
查看答案和解析>>
科目: 来源: 题型:
甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图所示。下列说法正确的是( )
A.甲是N2O4
B.a点处于平衡状态
C.t1~t2时间内v正(乙)<v逆(甲)
D.反应进行到t2时刻,改变的条件可能是升高温度
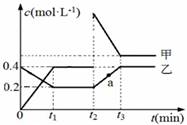
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com