
科目: 来源: 题型:
铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。
[方案一]
[实验方案] 将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_______________________________。
[实验步骤]
(1)称取10.8 g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0 mol·L-1的NaOH溶液中,充分反应。则NaOH溶液的体积V≥__________mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______________(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案] 将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用下列实验装置完成实验:
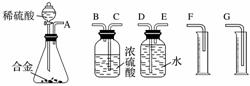
你认为最简易的装置其连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满)。

(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
①装置中导管a的作用是_____________________________________;
②实验前后量气管中液面读数分别为V1 mL、V2 mL,则产生氢气的体积为__________mL;
③若需确定产生氢气的量,还需测定的数据是___________________________。
查看答案和解析>>
科目: 来源: 题型:
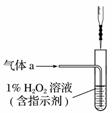
中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
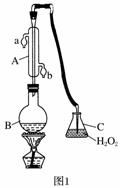
(1)仪器A的名称是______________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为________________________________。
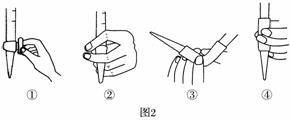
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2。

①气体a的成分是________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2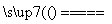 1________+3________。
1________+3________。
(2)将气体a通入测硫装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式
________________________________________________________________________
________________________________________________________________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
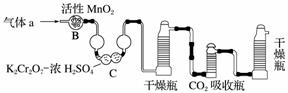
①气体a通过B和C的目的是______________________________________。
②计算钢样中碳的质量分数,应测量的数据是________________________________________________________________________
________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为 ,表中b c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(3)该反应的平衡常数表达式K= ,在80℃时该反应的平衡常数K值为 (保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
N2O4的转化率越高
NO2的产量越大
N2O4与NO2的浓度之比越大
正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施
 增大N2O4起始浓度
增大N2O4起始浓度
向混合气中通入NO2
(C) 使用高效催化剂
(D) 升高温度
(6)如图是80℃时容器中N2O4浓度的变化
图,请在该图中补画出该反应在60℃反
应时N2O4浓度的变化曲线。
查看答案和解析>>
科目: 来源: 题型:
甲、乙两容器,甲的容积固定,乙的容积可变。在一定温度下向甲中通入3molN2和4molH2,反应达到平衡时,生成NH3的物质的量为a mol。
(1)相同温度下,向乙中通入2molNH3,且保持容积与甲相同,当反应达到平衡时,各物质的浓度与甲中平衡时相同。起始时乙中通入____ molN2和_____ __molH2 。
(2)相同温度下,若乙中通入6 molN2和8molH2,且保持压强与甲相同,当反应达到平衡时,生成氨的物质的量为b mol,则a/b_____ ____1/2;若乙与甲的容积始终相等,达到平衡时,生成氨的物质的量为c mol,则a/c ____ _____1/2(填<、或>、或=)
查看答案和解析>>
科目: 来源: 题型:
在室温下,把5.0mL0.10mol/L 的Na2S2O3(aq)和5.0mL0.10mol/L 的H2SO4(aq)混合,析出淡黄色沉淀,回答下列问题:
(1)反应的离子方程式是 。
(2) 若在混合溶液中加入几滴5.00mol/L 的H2SO4(aq),则析出淡黄色沉淀的速率 (填“明显加快”“明显减慢”或“基本不变”,下同),若在混合溶液中加入5.0mL8.00mol/L 的Na2SO4(aq),则析出淡黄色沉淀的速率 .
查看答案和解析>>
科目: 来源: 题型:
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
查看答案和解析>>
科目: 来源: 题型:
|
|
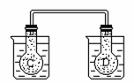 如右图所示,在常温下容器 A 中盛有 500mL 蒸馏水,在容器 B 中盛有 500ml 1mol/L的盐酸,在烧瓶 C 和 D 中充满二氧化氮气体,并用导管将它们连通。向 A 容器中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶
如右图所示,在常温下容器 A 中盛有 500mL 蒸馏水,在容器 B 中盛有 500ml 1mol/L的盐酸,在烧瓶 C 和 D 中充满二氧化氮气体,并用导管将它们连通。向 A 容器中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶 解;向B中加入 10g 苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶 C 和 D 中气体的颜色变化是____ __ 。
① 不变 ② 烧瓶 C 中颜色变深,D 中变浅
③ 烧瓶 D 中 变深, C 中变浅 ④ 两个烧瓶中的颜色都变深
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,xA + yB zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
⑴若A、B、C都是气体,减压后向逆反应方向移动,则x、y、z之间的关系是 。
⑵已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 方向移动。
⑶若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为 。
⑷加热后C的百分含量减少,则正反应是 反应(选填“吸热”、“放热”)
查看答案和解析>>
科目: 来源: 题型:
 对于一定条件下的可逆反应2N2O5(g) 4NO2(g) + O2(g) △H>0,在一定条件下达到平衡状态后,若改变条件(未说明的条件不变),对有关物理量及平衡状态有何影响?将变化结果(填增大、减小、不变、变深、变浅),填入空格。
对于一定条件下的可逆反应2N2O5(g) 4NO2(g) + O2(g) △H>0,在一定条件下达到平衡状态后,若改变条件(未说明的条件不变),对有关物理量及平衡状态有何影响?将变化结果(填增大、减小、不变、变深、变浅),填入空格。
(1)压强不变,充入少量氦气,混合气体的颜色 。
(2)升高体系的温度,混合气体的平均相对分子质量 。
(3)使用正催化剂,正反应速率 ,逆反应速率 ,N2O5的转化率 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com