
科目: 来源: 题型:
将2 mol I2(g)和1 mol H2置于某2 L的密闭容器中,在一定温度下发生反应:I2(g)+H2(g)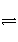
 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
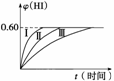
(1)达到平衡时,I2(g)的物质的量浓度为__________。
(2)若改变反应条件,在甲条件下φ(HI)的变化如图曲线(Ⅰ)所示,在乙条件下φ(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是________(填入下列条件的序号,下同),乙条件可能是__________。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达到平衡时,HI的体积分数仍为0.60,则a、b、c的关系是__________。
查看答案和解析>>
科目: 来源: 题型:
在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)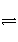
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1) 写出该反应的平衡常数表达式:K=_____________________________________。
已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v=________________________________________________________________________。
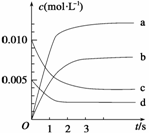
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目: 来源: 题型:
已知反应:2NO2(g)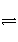
 N2O4(g)是放热反应,为了探究温度对化学平衡的影
N2O4(g)是放热反应,为了探究温度对化学平衡的影
响,有人做了如下实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500 mL 6 mol·L-1的HCl溶液和盛有500 mL蒸馏水的烧杯中(两烧杯中溶液的温度相同)。
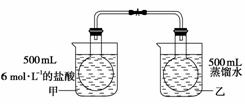
(1) 该实验用两个经导管连通的烧瓶,其设计意图是
________________________________________________________________________
________________________________________________________________________。
(2) 向烧杯甲的溶液中放入125 g NaOH固体,同时向烧杯乙中放入125 g硝酸铵晶体,搅拌使之溶解。甲烧瓶内气体的颜色将____________,原因是
________________________________________________________________________
________________________________________________________________________;
乙烧瓶内气体的颜色将__________,原因是
________________________________________________________________________
________________________________________________________________________。
(3) 该实验欲得出的结论是
________________________________________________________________________
________________________________________________________________________。
(4)某同学认为该实验的设计并不完全科学,他指出此时影响化学平衡的因素不止一个,你认为他所指的另一个因素是__________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)估计下列各变化过程是熵增还是熵减。
①NH4NO3爆炸:2NH4NO3(s)===2N2(g)+4H2O(g)+O2(g)
②水煤气转化:CO(g)+H2O(g)===CO2(g)+H2(g)
③臭氧的生成:3O2(g)===2O3(g)
(2)可逆反应A(g)+B(g)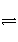
 2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。
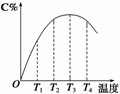
①由T1向T2变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
②由T3向T4变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
③反应在________温度下达到平衡。
④此反应的正反应为______热反应。
查看答案和解析>>
科目: 来源: 题型:
根据下列有关图象,说法正确的是( )
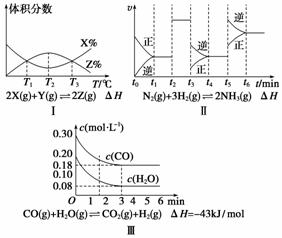
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B.由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C.由图Ⅱ知,t3时采取增大反应体系压强的措施
D.若图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)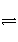
 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A.②⑧ B.①⑥ C.②④ D.③⑧
查看答案和解析>>
科目: 来源: 题型:
已知反应mX(g)+nY(g)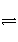
 qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目: 来源: 题型:
反应CH3OH(l)+NH3(g)===CH3NH2(g)+H2O(g)在某温度自发向右进行,若反应的|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ·mol-1,则下列正确的是( )
A.ΔH>0,ΔH-TΔS<0 B.ΔH<0,ΔH-TΔS>0
C.ΔH>0,ΔH-TΔS>0 D.ΔH<0,ΔH-TΔS<0
查看答案和解析>>
科目: 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g)
ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
查看答案和解析>>
科目: 来源: 题型:
反应:L(s)+aG(g)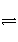
 bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡时混合气体中G的体积分数。据此可判断( )
bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡时混合气体中G的体积分数。据此可判断( )
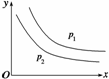
①上述反应是放热反应 ②上述反应是吸热反应 ③a>b ④a<b
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com