
科目: 来源: 题型:
下列叙述正确的是()
| A. | Na2O与Na2O2都能和水反应生成碱,它们是碱性氧化物 | |
| B. | Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 | |
| C. | Na2O2应保存于密封、干燥带玻璃塞的广口瓶中 | |
| D. | Na2O2可作供氧剂,而Na2O不行 |
查看答案和解析>>
科目: 来源: 题型:
将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2②Na2O③Na2CO3④NaCl()
| A. | ①>②>③>④ | B. | ①>②>④>③ | C. | ①=②>③>④ | D. | ①=②>③=④ |
查看答案和解析>>
科目: 来源: 题型:
在10mL0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为()
| A. | 0mL | B. | 0.672mL | C. | 1.34mL | D. | 2.240mL |
查看答案和解析>>
科目: 来源: 题型:
向各盛有1L水的甲、乙、丙、丁四个烧杯内分别加入等物质的量的Na、Na2O、Na2O2和NaOH,固体完全溶解后,各烧杯中溶质的质量分数大小顺序是()
| A. | 甲<乙<丙<丁 | B. | 丁<甲<乙=丙 | C. | 甲=丁<乙=丙 | D. | 丁<甲<丙<乙 |
查看答案和解析>>
科目: 来源: 题型:
工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl = CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
⑴为除去溶液中F e2+,可采用的方法是 。
e2+,可采用的方法是 。
⑵工业上为除去溶液中的Fe2+,常 使用NaClO,当向溶液中加入NaClO后,可能发生反应的离子方程式
使用NaClO,当向溶液中加入NaClO后,可能发生反应的离子方程式 为_____________________________________________________。溶液的pH变化是 。
为_____________________________________________________。溶液的pH变化是 。
⑶若此溶液只含Fe3+时,要调整pH在3~4之间,此时最好向溶液中加入 。
(4)已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全______ ___(填“能”或“否”)。
___(填“能”或“否”)。
查看答案和解析>>
科目: 来源: 题型:
实验室常用邻苯二甲酸氢钾(KHC8H4O4)来滴定氢氧化钠的的浓度,反应如下:KHC8H4O4 + NaOH = KNaC8H4O4 + H2O。若氢氧化钠的溶液浓度为0. 1mol·L-1,到达终点时,溶液的PH约为9.1.
(1)为标定氢氧化钠溶液的浓度,应选 用作指示剂,达到滴定终点时溶液由
色变为 色。
(2)在测定氢氧化钠溶液浓度时,有下列操作:①向溶液中加入1-2滴指示剂 ②向锥形瓶中加20-30ml蒸馏水溶解 ③用氢氧化钠溶液滴定到终点,半分钟不褪色④重复以上操作 ⑤准确称取0.4-0.5g邻苯二甲酸氢钾加入250ml锥形瓶中⑥根据两次实验数据计算氢氧化钠的物质的量浓度。
以上各步中,正确的(填序号)操作顺序是
(3)上述操作中,将邻苯二甲酸氢钾直接放到锥形瓶中溶解,对实验是否有影响?
并说明理由: 

(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果 (填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(分子量204.2)晶体0.5105g,溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH 20 mL,则NaOH溶液的浓度为 (结果保留四位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
工业上制备BaCl2的工艺流程图如下:
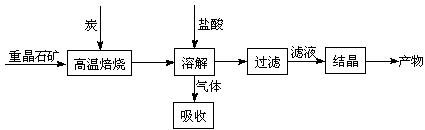
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaS O4(s) + 4C(s)
O4(s) + 4C(s) 4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,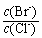 = 。
= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。回答下列问题:
①在同一溶液中,H2CO3、HCO3-、 CO32-(填:“能”或“不能”) 大量共存。
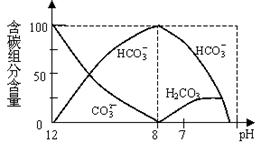 ②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: 。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: 。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh

 2×10-4,当溶液中c(HCO3-)︰c(CO32-)
2×10-4,当溶液中c(HCO3-)︰c(CO32-) 2︰1时,溶液的pH
2︰1时,溶液的pH 。
。
查看答案和解析>>
科目: 来源: 题型:
已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离于浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为
(填编号)。
(2)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+) c(OH-)。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好是中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)(填“大于”“小于”或“等于”),混合后溶液中的各离子浓度的大小关系为
查看答案和解析>>
科目: 来源: 题型:
在常温下10mL pH=10的KOH溶液中,加人pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是 ( )
A c(A-)=c(K+) B c(H+)=c(OH-)<c(K+)<c(A-)
C V总≧20mL D V总≦20mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com