
科目: 来源: 题型:
下列叙述正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-)
查看答案和解析>>
科目: 来源: 题型:
40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )

A.在pH=9.0时,c(NH4+)>c(HCO )>c(NH2COOˉ)>c(CO32-)
)>c(NH2COOˉ)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ)
C.随着CO2的通入, 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
查看答案和解析>>
科目: 来源: 题型:
 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当 =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 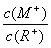 增大
增大
查看答案和解析>>
科目: 来源: 题型:
I.二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。
(1)工业上采用氯酸钠制备ClO2:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是 (填字母序号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②当生成0.4molClO2时,转移电子 mol。
③若采用双氧水还原氯酸钠制备ClO2,更适合用于饮用水的消毒,其主要原因是 。
(2)ClO2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用ClO2
氧化除去CN-的离子方程式 。
II.下图甲是用H2还原 CO2制备甲醇的原电池工作原理示意图;图乙是用图甲作电源实现CO2制备碳氢化物的工作原理示意图(用KHSO4溶液作电解液)。
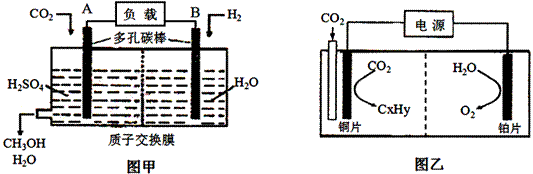
(1)图甲中A的电极名称是 。
(2)若乙中碳氢化物为C2H4, 则铜电极的电极反应为 。
(3)若通入的CO2全部参加反应,甲乙中共消耗0.6molCO2 时,图甲中通过质子交换膜的H+ 的物质的量为 。
查看答案和解析>>
科目: 来源: 题型:
I.在体积为2L的密闭容器中,加入1mol A与4mol B发生反应:
A(g)+ 2B(g) 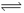 2 C(g) △H= QkJ/mol。达平衡时A的转化率α与温度的变化如下表。
2 C(g) △H= QkJ/mol。达平衡时A的转化率α与温度的变化如下表。
| 温度℃ | 200 | 300 | 500 |
| α | 0.5 | 0.4 | 0.3 |
(1)Q 0(填< 、>、=)。
(2)在200℃时,若经5min达到平衡,则用物质C表示的平均速率为 。
(3)200℃时,将容器体积压缩为1L,平衡时的平衡常数K= 。
II.已知: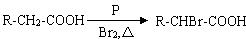
由常见的有机物A[CH2=C(CH3)2]可以实现如下的转化:
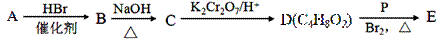
(1)A的系统命名为 ;B→C的反应类型是 。
(2)C的一种同类别的同分异构体M,M能发生催化氧化反应生成醛,则M 的结构简式为 。
(3)写出E与足量的氢氧化钠溶液共热反应的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
氨基甲酸铵(H2NCOONH4)是一种白色固体,易水解、受热易分解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g) H2NCOONH4(s) △H<0
H2NCOONH4(s) △H<0

(注:四氯化碳与液体石蜡均为惰性介质)
(1)如用图1装置制取氨气,分液漏斗中的试剂名称是 。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
①发生器用冰水冷却的目的是 。
液体石蜡鼓泡瓶的作用是 。
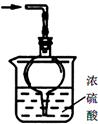 ②从反应后的混合物中分离出产品的实验方法是 (填操作名称)。为了得到纯净的产品,应采取的方法是 (填选项序号)。
②从反应后的混合物中分离出产品的实验方法是 (填操作名称)。为了得到纯净的产品,应采取的方法是 (填选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 减压40 ℃以下烘干
③尾气处理装置如右图所示。球形干燥管的作用: ;
浓硫酸的作用: 。
(3)取因部分变质而混有NH4HCO3的氨基甲酸铵样品15.64g,用足量石灰水充分处理后,使样品中所有碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为20 g。则样品中氨基甲酸铵的物质的量分数为 。
查看答案和解析>>
科目: 来源: 题型:
硅、硫、钠、铁、铝、铜等元素及其化合物在日常生活和生产中应用广泛,回答下列问题:
(1)Si元素在周期表中的位置是 , Na2S的电子式为 。
(2)H2S 、H2O 、SiO2、Na2O熔沸点由高到低的顺序为 。(用化学式表示)
(3)工业上常用氯化铁溶液腐蚀铜制电路板,反应的离子方程式是 。
要从上述腐蚀液中获得较纯的CuCl2溶液,需要将杂质 FeCl3和FeCl2除去,首先将Fe2+氧化成Fe3+,再向溶液中加入 (填化学式),最后过滤。
(4)在CuSO4溶液中通入过量的NH3,小心蒸发,最终得到[ Cu(NH3)4]SO4 晶体,晶体中含有的化学键除普通的共价键外,还含有 。
(5)将4.6g Na和8.1gAl组成的混合物投入到足量的水中,生成H2在标准状况下的体积为 。
查看答案和解析>>
科目: 来源: 题型:
在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?) 2C(g)+D(g),
2C(g)+D(g),
C的体积分数(C%) 随时间的变化趋势符合下图关系:
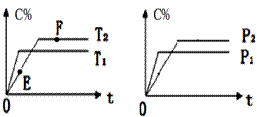
下列说法正确的是
A.E点的v(逆)大于F点的v(正)
B.若给容器加热,该反应的平衡常数K将增大
C.若在F点时给容器加压,达新平衡时C的浓度将增大
D.在恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率将增大
查看答案和解析>>
科目: 来源: 题型:
已知: CH4(g) + H2O(g) = CO(g) + 3H2(g) △H= +206kJ/mol
CO(g) + H2O(g) = CO2(g) + H2(g) △H= -41 kJ/mol
C—H、H—O、H—H的键能分别为413 kJ/mol、463kJ/mol、436 kJ/mol,
则CO2中C=O的键能为
A.797.5 kJ/mol B. 682 kJ/mol C.572 kJ/mol D.483 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
有机物M的结构简式如右图,下列说法正确的是
A.M在FeBr3 作催化剂时可与溴水发生取代反应
B.M与浓硫酸共热可发生消去反应
C.1molM发生消去反应时可消耗2molNaOH
D.M可发生消去、加成、取代、氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com