
科目: 来源: 题型:
烟气(主要污 染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见右图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是__________。
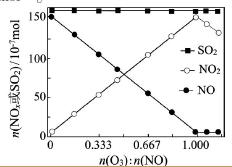 ②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 _________。
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 _________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:___________。
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=________[用c(SO42-)、Ksp(CaSO3)和Ksp( CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是_________。
CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是_________。
查看答案和解析>>
科目: 来源: 题型:
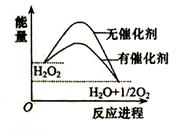 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2的平衡转化率
C.H2O2分解的热化学方程式:H2O2 → H2O + O2 + Q
D.反应物的总能量高于生成物的总能量
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.分子式为C2H6O的有机化合物性质相同
B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能
途径a:C
 CO+H2
CO+H2
 CO2+H2O
CO2+H2O
途径b:C
 CO2
CO2
C.在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数
D.通过化学变化可以直接将水转变为汽油
查看答案和解析>>
科目: 来源: 题型:
己知丙烷的燃烧热△H=-2215KJ·mol-1,若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( )
A.55 kJ B.220 kJ C. 550 kJ D.1108 kJ
查看答案和解析>>
科目: 来源: 题型:
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
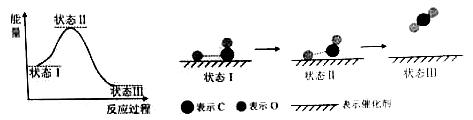
下列说法中正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ →状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目: 来源: 题型:
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知硫的燃烧热ΔH1= a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1
则x为( )
A.3a+b-c B.c +3a-b C.a+b-c  D.c+a-b
D.c+a-b
查看答案和解析>>
科目: 来源: 题型:
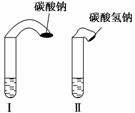
(1) 高中教材中有这样一个实验:在两支试管中分别加入3 mL稀盐酸(均足量)(只有浓度
小于1 mol·L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3 g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率等相关现象)_____________________________ ________________________________________________________________________
________________________________________________________________________;
②试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ∶Ⅱ=________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变凉,而盛Na2CO3粉末的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。
甲得出的结论是否正确________(填“正确”或“不正确”)。
(2)为研究是吸热反应还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):(注:每组固体全溶解且完全反应)
| 序号 | 试剂1 | 试剂2 | 混合前 温度 | 混合后最高或 最低温度 |
| A | 50 mL水 | 2.5 g NaHCO3固体 | 20℃ | 18.5℃ |
| B | 50 mL水 | 3.2 g Na2CO3固体 | 20℃ | 23.3℃ |
| C | 50 mL稀盐酸 | 2.5 g NaHCO3固体 | 20℃ | 17.4℃ |
| D | 50 mL稀盐酸 | 3.2 g Na2CO3固体 | 20℃ | 24.4℃ |
请你帮助填写相关内容:
① 该研究报告的题目是_________________________________________________
________________________________________________________________________;
②该实验中所用的仪器除试管、药匙(或V形纸槽)、气球、下端带环状玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和________________;
③通过上述实验可得出两条结论:
a.Na2CO3溶液和盐酸的反应是______(吸热或放热)反应;
b.NaHCO3溶液和盐酸的反应是______(吸热或放热)反应。
答案 (1)①两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多
②42∶53
③不正确
(2)①《NaHCO3、Na2CO3和盐酸反应过程中热效应的研究》
②托盘天平 温度计
③a.放热 b.吸热
查看答案和解析>>
科目: 来源: 题型:
煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)===CO2(g) ΔH=E1①
b.C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2②
H2(g)+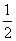 O2(g)===H2O(g) ΔH=E3③
O2(g)===H2O(g) ΔH=E3③
CO(g)+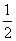 O2(g)===CO2(g) ΔH=E4④
O2(g)===CO2(g) ΔH=E4④
回答:
(1)上述四个热化学方程式中的哪些反应ΔH<0?
________________________________________________________________________。
(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A.a比b多 B.a比b少 C.a与b在理论上相同
(3)根据能量守恒定律,E1、E2、E3、E4之间的关系为
________________________________________________________________________
________________。
查看答案和解析>>
科目: 来源: 题型:
同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(s,白磷)+5O2(g)===P4O10(s)
ΔH1=-2 983.2 kJ·mol-1
②P(s,红磷)+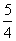 O2(g)===
O2(g)===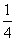 P4O10(s)
P4O10(s)
ΔH2=-738.5 kJ·mol-1
则白磷转化为红磷的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
相同状况下,能量状态较低的是______;白磷的稳定性比红磷____(填“高”或“低”)。
查看答案和解析>>
科目: 来源: 题型:
已知下列三个热化学方程式
①H2(g)+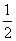 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g)
ΔH=+131 kJ·mol-1
写出碳燃烧生成CO和CO燃烧的热化学方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com