
科目: 来源: 题型:
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和 丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
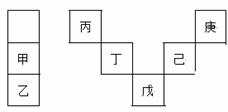 A.丙与戊的原子序数相差28
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
科目: 来源: 题型:
右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
 A.X、W、Z元素的原子半径及它
A.X、W、Z元素的原子半径及它 们的气态氢化物的热稳定性均依次递增
们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目: 来源: 题型:
CH4气体的燃烧热△H= -802kJ• mol-1,当CH4不完全燃烧生成CO气体和液态
H2O时,放出的热量为519 kJ。如果1 mol CH4与n g O2燃烧生成CO、CO2气体和液
态H2O,放出731.25 kJ热量。
(1)写出CH4气体不完全燃烧的热化学方程式。
(2)计算n的值
查看答案和解析>>
科目: 来源: 题型:
现有部分短周期元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下,单质为双原子分子,分子中含有3对共用电子对,其简单氢化物的水溶液显碱性 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小的,其氧化物呈两性 |
(1)画出元素T原子结构示意图__________________________;
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是____(填序号);
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式为_______。
(4)元素T和氢元素以原子个数比1∶1形成的化合物的电子式为______,元素Z最高价氧化物的水化物与元素Y的最高价氧化物的水化物的溶液相互反应的离子方程式为 。
查看答案和解析>>
科目: 来源: 题型:
在一个小烧杯里,加入约20 g已研磨成粉末的氢氧化钡晶体,将小烧杯放在事先已滴有3—4滴水的玻璃片上,然后再加入约10 g NH4Cl晶体,并立即用玻璃棒迅速搅拌。试完成下列问题:
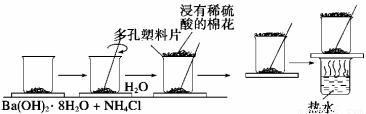
(1)写出有关反应方程式 ,该反应属于 反应。(填基本反应类型)
(2)实验中要立即用玻璃棒迅速搅拌的原因是__ 。
(3)如果实验中没有看到“结冰”现象,可能的原因是(列举三条) 。
(4)“结冰”现象说明了该反应是 热(填“放”或“吸”),反应物的总能量比生成物的总能量 (填“高”或“低”);
(5)在上述实验过程中,用浸有稀硫酸的湿棉花置于多孔塑料板上的作用是 。
查看答案和解析>>
科目: 来源: 题型:
实验探究是体验知识的产生或形成过程的基本途径.下面是某同学探究实验报告的一部分,请填空:实验目的:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳
| 实验步骤 | 结论 |
| ①NaCl溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序: 氯、溴、碘 |
| ②KBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
(1)完成该实验需用到的仪器是______;
(2)CCl4在实验中所起的作用是______;
(3)在实验②中四氯化碳层颜色变化过程为______;
(4)该同学的实验缺陷是______,改进的办法是______.
查看答案和解析>>
科目: 来源: 题型:
用元素符号回答下列问题:在第三周期元素中(不包括稀有气体元素),原子半径最大的金属元素是______,原子半径最小的非金属元素是______;单质还原性最强的元素是_______;最高价氧化物对应的水化物碱性最强的元素是_____;气态氢化物最稳定的元素是_______。
查看答案和解析>>
科目: 来源: 题型:
(1)Na3N是一种重要的化合物,是由 键形成的,其中两种粒子的半径关系是:Na+ N3-(填“>”、“=”或“<”)。
(2)已知R2+离子核外有a个电子,b个中子。表示R原子符号是 。
(3)在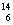 C、
C、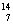 N、
N、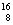 O、
O、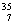 Cl、
Cl、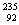 U、
U、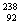 U中;互为同位素的是 。
U中;互为同位素的是 。
(4)原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A. ,B. 。(填“能”或“不能”)
若能,则请你写出构成原电池的负极电极反应式_________,正极电极反应式 。
(5)KOH的电子式:: ;NH4Cl中阴离子的电子式: 。
查看答案和解析>>
科目: 来源: 题型:
有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:
A.A>B>C>D B.C>A>B>D C.A>C>D>B D.B>D>C>A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com