
科目: 来源: 题型:
如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。
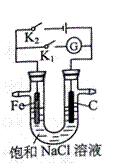 下列叙述正确的是:
下列叙述正确的是:
A.K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,有蓝色沉淀出现
B.K1闭合,电流方向由铁棒经导线流向石墨棒
C.K2闭合,碳棒是阴极
D.K2闭合,电路中通过0.2NA个电子时,两极共产生4.48L气体
查看答案和解析>>
科目: 来源: 题型:
已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=+130kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、a kJ·mol-1和462kJ·mol-1,
则a为
A.496 B.118 C.350 D.130
查看答案和解析>>
科目: 来源: 题型:
下列有关电解质溶液中粒子浓度关系正确的是
A.CO2的水溶液中:c(H+)>c(HCO3-)=2c(CO32-)
B.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-)
C.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
D.等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小
查看答案和解析>>
科目: 来源: 题型:
下列关于电化学原理应用中,正确的是
A.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2H+-2e-=H2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.钢铁发生电化学腐蚀的负极反应式:Fe-2e- == Fe2+
D.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
查看答案和解析>>
科目: 来源: 题型:
下列叙述中,正确的是
①电解池是将化学能转变成电能的装置 ②金属和石墨导电均为物理变化,电解质溶液导电是化学变化 ③不能自发进行的氧化还原反应,通过电解的原理有可能实现 ④将铜锌原电池用含KCl的盐桥相连时,盐桥中的Cl-会移向正极区 ⑤利用电化学原理保护金属主要有两种方法,分别是牺牲阳极的阴极保护法和外加直流电的阴极保护法
A.①②③④ B.④ C.①④⑤ D.②③⑤
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、M代表四种金属,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+离子和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为
A.M>Z>X>Y B.X>Y>Z>M C. X>Z>Y>M D.X>Z>M>Y
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.常温pH=11的烧碱溶液与pH=3的稀醋酸等体积混合后,滴入石蕊试液呈红色
B.T ℃时,pH=6的纯水中,含10–8 NA个OH-(NA表示阿伏加德罗常数)
C.将NaAlO2 、FeCl3 、Al2(SO4)3的水溶液分别在蒸发皿中加热、蒸干并灼烧,
都能得原溶质
D.常温在由水电离的c(H+)=1×10–13mol/L的溶液里,能大量存在NH4+、Fe2+、NO3-
查看答案和解析>>
科目: 来源: 题型:
下列事实不能用化学平衡移动原理解释的是
A.收集氯气可以用排饱和食盐水的方法
B.可用浓氨水和氢氧化钠固体快速制取氨气
C.加催化剂,使N2和H2在一定的条件下转化为NH3
D.20℃时,AgCl在蒸馏水中的溶解度比在0.1mol/LNaCl溶液中的溶解度大
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.其他条件不变时增大压强,能使全气体反应体系中活化分子百分数增加
B.中和反应都是放热反应
C.在FeCl3溶液和KSCN溶液反应的平衡体系中,加入KCl固体,平衡逆向移动
D.熵增大的反应不一定自发, 但自发反应熵一定增大
查看答案和解析>>
科目: 来源: 题型:
在恒容绝热条件下,一定能说明反应A(g)+B(?) 2C(g)已达到平衡状态的是
2C(g)已达到平衡状态的是
A.容器内的密度不再变化 B.C的生成速率与A的分解速率之比为2:1
C.混合物的平均摩尔质量不再变化 D.容器内的温度不再发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com