
科目: 来源: 题型:
有FeO、Fe2O3的混合物若干克,在足量H2气流中,加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解,需1 mol·L-1的盐酸的体积至少为
A.0.05 L B.0.1 L C.0.2 L D.1 L
查看答案和解析>>
科目: 来源: 题型:
)已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体, C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
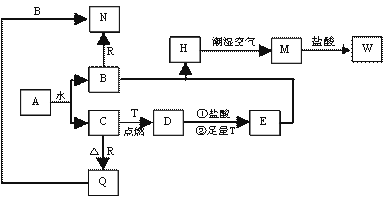
(1)写出下列物质的化学式:
A: D: R: 。
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式: ;
向N中通足量CO2时反应的离子方程式: ;
D与盐酸反应的离子方程式: 。
(3)简述检验气体C的方法: 。
查看答案和解析>>
科目: 来源: 题型:
) 向27.2Cu和Cu2O的混合物中加入某浓度的稀HNO3500mL,固体完全溶解后在所得溶液中加入1mol/L 的NaOH溶液1L使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。则:
(1)Cu与Cu2O 的物质的量之比为 。
(2)HNO3的物质的量浓度为 。
查看答案和解析>>
科目: 来源: 题型:
向一种溶液中滴加另一种溶液后,溶液的颜色不发生显著变化的是
A.氯化亚铁溶液中加入双氧水 B.硫酸铁溶液中滴加硫氰酸钾溶液
C.硫酸铜溶液中滴加硝酸钡溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
查看答案和解析>>
科目: 来源: 题型:
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流程进行一系列反应来制备无水AlCl3。
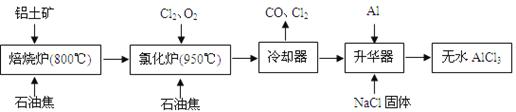
(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是 晶体,其结构式为 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是 。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为: 。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: 。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为: 。
查看答案和解析>>
科目: 来源: 题型:
下列各项反应对应的图像错误的是
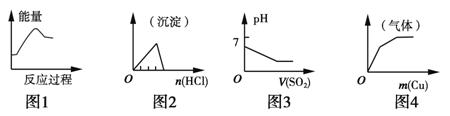
A.图1:将饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体
B.图2:将稀盐酸逐滴加入一定量偏铝酸钠溶液中
C.图3:将二氧化硫逐渐通入一定量氯水中
D.图4:将铜粉逐渐加入一定量浓硝酸中
查看答案和解析>>
科目: 来源: 题型:
 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
①反应C+G B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
⑴ ①中反应的化学方程式为
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉 克
(3) C与过量NaOH溶液反应的离子方程式为 ,
反应后的溶液与过量的化合物I反应的离子方程式为
(4) E与I反应的化学方程式为
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol

查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验1、2中Al所作的电极是否相同?
________________________________________________________________________。
(2)指出铝和石墨的电极并写出实验3中的电极反应式和电池总反应方程式。
铝为( ):
________________________________________________________________________。
石墨为( ):
________________________________________________________________________。
电池总反应:
________________________________________________________________________。
(3)实验4中的铝作正极还是负极?________,为什么?
________________________________________________________________________
________________________________________________________________________。
(4)解释实验5中电流计指针偏向铝的原因:
________________________________________________________________________
________________________________________________________________________。
(5)根据实验结果总结:在原电池中金属铝作正极还是负极受到哪些因素的影响?________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
利用反应Cu+2FeCl3===CuCl2+2FeCl2组成一个化学电池。
(1)指出正极为________,电极反应式为__________________________________;负极为____________,电极反应式为____________________________。
(2)若电池内溶液为100 mL 0.5 mol/L的FeCl3溶液;当溶液中FeCl3全部被还原成FeCl2时,溶液中CuCl2的物质的量浓度是________,导线上通过的电子是________mol。
查看答案和解析>>
科目: 来源: 题型:
按如图所示进行铁腐蚀的实验,一周后观察:
 (1)若试管中液面上升,发生的是________腐蚀,电极反应为:
(1)若试管中液面上升,发生的是________腐蚀,电极反应为:
正极_________________________________________________________;
负极___________________________________________________________。
(2)若试管中液面下降,发生的是____________腐蚀,电极反应为:正极
________________________________________________________________________;
负极________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com