
科目: 来源: 题型:
橄榄石型LiFePO4是以中国锂离子电池正极材料,下列有关LiFePO4的说法中不正确的是
A. LiFePO4中铁元素的化合价为+2价
B. LiFePO4中Li、P、O均属于短周期元素
C. 能与稀硝酸发生氧化还原反应
D. LiFePO4中Li、Fe、P均属于主族元素
查看答案和解析>>
科目: 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是
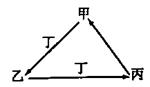
A.若甲为N2,则丁可能是O2
B.若甲为Fe,则丁可能是Cl2
C.若甲为AlCl3,则丁可能是NH3
D. 若甲为NaHCO3,则丁可能是HCl
查看答案和解析>>
科目: 来源: 题型:
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O= 4Fe(OH)3↓+O2↑+8Na+ 则下列说法正确的是( )
A、该反应中 Fe2+是还原剂,O2 是还原产物
B、4molNa2O2 在反应中共得到 8NA 的电子
C、Fe(OH)3 既是氧化产物又是还原产物,每生成 4mol Fe(OH)3 反应过程中共转移电子 6mol
D、反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
查看答案和解析>>
科目: 来源: 题型:
部分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是 ( )
A.滤液A中的阳离子为Fe2+、Fe3+、H+ B.样品中CuO的质量为4.0 g
C.样品中Fe元素的质量为2.24 g D.V=896 mL
查看答案和解析>>
科目: 来源: 题型:
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 ;
(2)过程Ⅰ加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程Ⅱ中发生反应的化学方程式为 ;
;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为 。
查看答案和解析>>
科目: 来源: 题型:
下列有关物质用途的说法中,正确的是( )
A.玻璃容器可长期盛放各种酸 B.硝酸常用作金属铜加工前的酸洗
C.碳酸钠可用于治疗胃酸过多 D.三氧化二铁常用于生产红色油漆和涂料
查看答案和解析>>
科目: 来源: 题型:
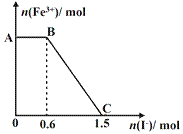
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I- =2Fe2++I2
C.若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则有蓝色沉淀生成
D.开始加入的K2Cr2O7为0.25 mol
查看答案和解析>>
科目: 来源: 题型:
新型材料纳米级铁粉与普通铁粉具有不同的性质。已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4。
(1)写出温度低于570℃时反应的化学方程式 。
(2)中学教材中用右图所示实验装置,完成铁粉与水蒸气反应的演示实验。实验中使用肥皂液的作用是
。
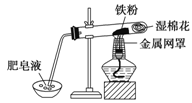
(3)如果提供给你3支试管、水槽、蒸发皿、胶塞、导管、酒精灯及其必要的仪器和物品,请在答题卷的方框中画出你设计的实验装置示意图发生该反应并有氢气的收集装置图(包括反应时容器中的物质)。
 |
说明:①本题装置示意图中的仪器可以用下面的方式表示。
水槽:
 试管:
试管:
 蒸发皿:
蒸发皿:
 玻璃导管:
玻璃导管:
 或
或
 (但应标示出在液面上或液面下)
(但应标示出在液面上或液面下)
②铁架台、石棉网、酒精灯、玻璃导管之间的联接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,标以“△”表示。
(4)乙同学为了探究实验后的固体产物是否存在Fe3O4(假定铁全部反应完全)设计下列实验方案:
①取固体样品m1 g,溶于足量的稀盐酸;
②向①反应后的溶液X中加入足量H2O2的和氨水,充分反应后,过滤、洗涤、干燥;
③将②中所得固体进行灼烧,得到红棕色固体m2 g。
溶液X中发生氧化还原反应的离子方程式为 ;m1与m2符合 关系时,才能确定固体样品中一定只存在Fe3O4。
查看答案和解析>>
科目: 来源: 题型:
.现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
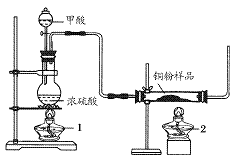
(1)制备一氧化碳的化学方程式是___________________。
(2)实验中,观察到反应管中发生的现象是_____________;尾气的主要成分是_________。
(3)反应完成后,正确的操作顺序为________(填字母)
a.关闭漏斗开关 b.熄灭酒精灯1 c.熄灭酒精灯2
(4)若实验中称取铜粉样品10.0 g,充分反应后,反应管中剩余固体的质量为9.6 g,则原样品中单质铜的质量分数为________。
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的最佳方案:
①设计方案的主要步骤是(不必描述操作过程的细节)__________;
②写出有关反应的化学方程式:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com