
科目: 来源: 题型:
黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
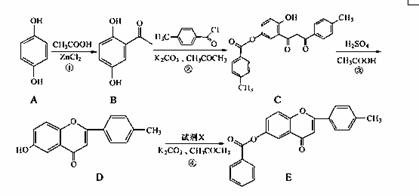
请回答下列问题:
(1)化合物B中的含氧官能团为 和 (填名称)。
(2)反应③中涉及到的反应类型有水解反应、 和 。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为 。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式: 。
(5)写出反应①的化学方程式 。
(6)已知: 。
。
根据已有知识并结合相关信息,写出以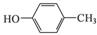 和CH3COOH为原料制备
和CH3COOH为原料制备
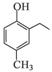 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
查看答案和解析>>
科目: 来源: 题型:
非血红素铁是食物中的铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物。
(1)Fe2+基态核外电子排布式为 。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为▲(填化学式)。
(3)蛋白质分子中氨基氮原子的轨道杂化类型是 ;
1mol 乙酸分子中含有σ的键的数目为 。
(4)把氯气通入黄血盐(K4)溶液中,得到
赤血盐(K3),写出该变化的化学方程
式 。
(5)FeO晶胞结构如右图所示,FeO晶体中Fe2+配位数为 。
查看答案和解析>>
科目: 来源: 题型:
由菱镁矿(主要成分为MgCO3)制阻燃型氢氧化镁的工艺流程如下:
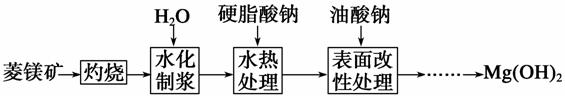
(1)从图1和图2可以得出的结论为__________________、____________________。
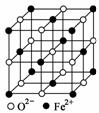
(2)水化反应MgO+H2O===Mg(OH)2能自发进行的原因是____________________。
(3)结合元素周期律和下表可知,金属氢氧化物受热分解的规律有__________________。(写一条即可)
部分主族元素的金属氢氧化物热分解温度/℃
| LiOH | NaOH | KOH | Al(OH)3 | Mg(OH)2 | Ca(OH)2 | Ba(OH)2 |
| 924 | 不分解 | 不分解 | 140 | 258 | 390 | 700 |
(4)已知热化学方程式:Mg(OH)2(s)===MgO(s)+H2O(g) ΔH=+81.5 kJ·mol-1
①Mg(OH)2起阻燃作用的主要原因是________________________________________
________________________________________________________________________。
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是____________。
查看答案和解析>>
科目: 来源: 题型:
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
(2)实验装置(如图所示)

(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xg AlN样品置于锥形瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应。
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量
(填化学式),与烧瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为 (该实验条件下的气体摩尔体积为Vm)。
查看答案和解析>>
科目: 来源: 题型:
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
①写出CO2与H2反应生成CH4和H2O的热化学方程式
已知: CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
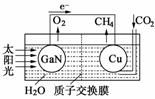
② 科学家用氮化镓材料与铜组装如右图的人工光合系统,
利用该装置成功地实现了以CO2和H2O合成CH4。
写出铜电极表面的电极反应式 。为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
③ 另一生成CH4的途径是CO(g)+3H2(g) CH4(g)+H2O(g)。某温度下,将0.1 mol CO和0.3 molH2充入10L的密闭容器内发生反应CO(g)+3H2(g)
CH4(g)+H2O(g)。某温度下,将0.1 mol CO和0.3 molH2充入10L的密闭容器内发生反应CO(g)+3H2(g)  CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K= 。(计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K= 。(计算结果保留两位有效数字)
天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入
空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)  2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
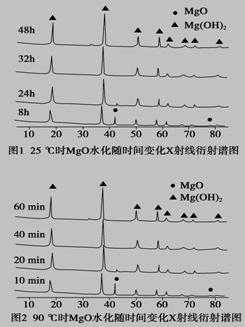
在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”
或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。
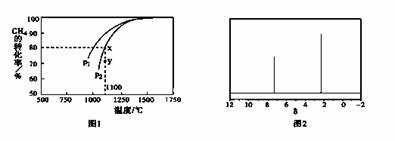
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如下图2,则X的结构简式为 。
查看答案和解析>>
科目: 来源: 题型:
粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:

已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等
(1)写出烧结过程中铝元素转化的化学方程式 。
(2)操作a为冷却、研磨,其中研磨的目的是 。
(3)浸出过程中,NaFeO2可完全水解,水解反应的离子方程式为 。
(4)操作b的名称是 ,所用的玻璃仪器有 、 和烧杯。
(5)“碳化”时生成沉淀,沉淀的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
仅用下表提供的仪器和药品,就能达到相应实验目的是( )
| 编号 | 仪器 | 药品 | 实验目的 |
| A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、钥匙、玻璃棒 | NaCl固体、蒸馏水 | 配制一定质量分数的NaCl溶液 |
| B | 分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 | 盐酸、大理石、硅酸钠溶液 | 证明非金属性:Cl>C>Si |
| C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
| D | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液、NaOH溶液 | 提纯混有MgCl2杂质的AlCl3溶液 |
查看答案和解析>>
科目: 来源: 题型:
已知:某温度时,KW=1.0×10-12。在该温度下,测得0.1mol·L-1Na2A溶液PH=6,则下列说法正确的是
A.H2A在水溶液中的电离方程式为:H2A=H++HA-,HA-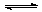 H++A2-
H++A2-
B.常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-)
C.相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等
D.0.0l mol·L-l的NaHA溶液pH>2
查看答案和解析>>
科目: 来源: 题型:
短周期主族元素X、Y、Z、W在元素周期表中的位置关系如下图,下列推论合理的是
 A.若X、Y、Z、W中只有一种为金属元素,则W一定为铝元素
A.若X、Y、Z、W中只有一种为金属元素,则W一定为铝元素
B. 若W的核电荷数是Y的两倍,则W的氧化物可作半导体材料
C.若Z的核电荷数是Y的两倍,则X的氢化物水溶液显酸性
D. 若Y、W的简单阴离子都能破坏水的电离,则Z的简单阴离子也一定能破坏水的电离
查看答案和解析>>
科目: 来源: 题型:
关于下列各图像的说法中正确的是
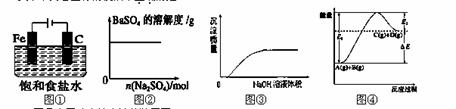
A.图①表示防止铁腐蚀的装置图
B.图②表示向BaSO4饱和溶液中加入硫酸钠
C.图③表示将NaOH溶液滴入Ba(HCO3)2溶液中
D.图④表示反应物的总键能大于生成物的总键能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com