
科目: 来源: 题型:
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是( )
A.氧化性:ClO –>I2>SO42– B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色 D.次氯酸钠可以与亚硫酸钠共存
查看答案和解析>>
科目: 来源: 题型:
我国的新(饮用天然矿泉水国家标准)规定了饮用水中可能致癌物溴酸盐的限值:0.01mg/L,日前很多饮用水企业都采用臭氧消毒法进行水的消毒,这个过程可能生成溴酸盐。原因是水中的Br-被臭氧氧化为BrO2-,其过程示意为:
Br-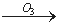 BrO-
BrO-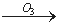 BrO2-
BrO2-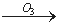 BrO3-,下列有关说法正确的是 ( )
BrO3-,下列有关说法正确的是 ( )
A.臭氧消毒法和明矾净水原理相同,都是利用胶体吸附原理
B.若改用氧气消毒,可避免生成溴酸盐
C.BrO3- 氧化性比O3强
D.生成溴酸盐的过程是给水消毒的副反应,需控制条件减少BrO3-的产生
查看答案和解析>>
科目: 来源: 题型:
已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性,A~I均为中学化学常见物质,它们之间的转化关系如下图所示。(部分生成物和反应条件已略去)
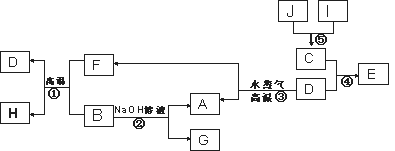
请回答下列问题:
(1) 写出组成物质D的元素在周期表中的位置:___________________。
(2) ①写出反应①的化学方程式:______________________________。
②由E的饱和溶液可以制得胶体,用化学方程式表示该过程的原理是_______________。
③写出反应②的离子方程式_________________________________。
(3) 已知G的水溶液显碱性,其原因是(用离子方程式表示)_________。
(4) J在H2O2分解反应中作催化剂。若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2价离子,该反应的离子方程式是___________________ 。
查看答案和解析>>
科目: 来源: 题型:
已知离子反应:Fe3++3SCN-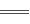 Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应时被氧化的元素是____________(填元素符号)。根据元素C、S、N的原子结构和共价键的相关知识推断出SCN-的结构式为_________________。
(4)实验②中反应的离子方程式为___________________________________________。
(5)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意
_________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,2.24L三氯甲烷含有分子数目为0.1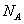
B.1 mol FeI2与足量氯气反应转移的电子数为2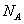
C.1 molCH3COONa 和少量CH3COOH溶于水所得中性溶液中,CH3COO-数目为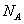
D.标准状况下,22.4L的乙烯中含有的共用电子对数为12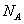
查看答案和解析>>
科目: 来源: 题型:
从硫化物中提取单质锑,经历以下两个过程: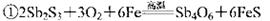
②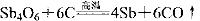 关于反应①、②的说法不正确的是
关于反应①、②的说法不正确的是
A.反应①中Sb元素被氧化
B.反应②中Sb元素被还原
C.标准状况下,每生成4 mol Sb时,消耗67.2LO2
D.反应②说明高温下C的还原性比Sb强
查看答案和解析>>
科目: 来源: 题型:
镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的。
已知: 氧化性: IO3— >Fe3+ >I2 还原性:S2O32— > I—
反应式:3I2 + 6OH— == 5I— + IO3— + 3H2O KI + I2 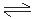 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)。用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色。
① 该红色物质是 (用化学式表示);CCl4中显示紫红色的物质是 (用电子式表示)。
② 第二份试液中加入足量KI固体后,反应的离子方程式为 ; 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?
(填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
A. Na2S2O3 B. AlCl3 C. Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+: 。
查看答案和解析>>
科目: 来源: 题型:
从海带中提取碘,可经过以下实验步骤完成,下列有关说法正确的是

A.在灼烧过程中使用的仪器有酒精灯、三脚架、泥三角、烧杯、玻璃棒
B.在上述氧化过程中发生的离子方程式为:2I-+H2O2 = I2 + 2OH-
C.在提取碘单质时,用酒精作萃取剂
D.在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出
查看答案和解析>>
科目: 来源: 题型:
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。下列有关说法正确的是
A.反应中NF3是氧化剂,H2O是还原剂
B.反应中被氧化与被还原的原子物质的量之比为2:1
C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e-
D. NF3在潮湿空气中泄漏会产生白雾、红棕色气体等现象
查看答案和解析>>
科目: 来源: 题型:
写出符合要求的化学方程式或离子方程式:
(1)实验室用二氧化锰和浓盐酸制备氯气的离子方程式_______________________________。
(2)用苯制备硝基苯的化学方程式____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com