
科目: 来源: 题型:
下列各项中操作或现象能达到预期实验目的的是 ( )
| 选项 | 实验目的 | 操作或现象 |
| A | 检验碳与浓硫酸反应后的气体产物 | 将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| D | 证明溶液中存在平衡: Fe3++3SCN-Fe(SCN)3 | 将1 mL KSCN溶液与1 mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深 |
查看答案和解析>>
科目: 来源: 题型:
分子式为C10H20O2的有机物在酸性条件下可水解为醇A和酸B,A经过连续氧化可转化为B,若不考虑立体异构,符合上述要求的醇和酸若重新组合,可形成的酯共有:( )
A.32 B.16 C.8 D.4
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、W、R属于短周期元素。已知它们都不是稀有气体元素,X的原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2︰1。 下列叙述错误的是
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y分别与Z、W、R以两种元素组成的常见化合物有5种
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R> W> Z
D.Y分别与Z、W、R以两种元素组成的常见化合物有5种Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为0.1 NA
B.标准状况下,22.4L甲苯中含C—H数目为8 NA
C.常温、常压下,1.6g O2和O3混合物中,氧原子的数目为0.1NA
D.0.1mol Na2O2与足量CO2反应时,转移的电子数目为0.2 NA
查看答案和解析>>
科目: 来源: 题型:
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
B.将“地沟油”制成肥皂,可以提高资源的利用率
C.我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料
D.推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染
查看答案和解析>>
科目: 来源: 题型:
铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式:  。
。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式: 。
(3)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S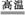 6Cu+SO2↑,该反应的氧化剂是 ;当生成19.2 g Cu时,反应中转移的电子为 mol。
6Cu+SO2↑,该反应的氧化剂是 ;当生成19.2 g Cu时,反应中转移的电子为 mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应: 。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取a g试样配成100 mL溶液,每次取25.00 mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式: 。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化 学方程式为I2+2Na2S2O3
学方程式为I2+2Na2S2O3 2NaI+Na2S4O6,平均消耗c
2NaI+Na2S4O6,平均消耗c mol·L-1的Na2S2O3溶液V mL。则试样中CuSO4·5H2O的质量分数为 。
mol·L-1的Na2S2O3溶液V mL。则试样中CuSO4·5H2O的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
Na2S2O3·5H2O俗称“海波”,是常用的脱氯剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20 ℃和70 ℃时的溶解度分别为60.0 g和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是实验室制备及相关性质实验。
制备海波的反应原理:Na2S O3+S
O3+S Na
Na 2S2O3
2S2O3
制备海波的流程:

(1)实验开始时 用1 mL乙
用1 mL乙 醇润湿硫粉的作用是 。
醇润湿硫粉的作用是 。
A.有利于亚硫酸钠与硫黄的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是  。
。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 。
A.无水乙醇 B.饱和NaCl溶液
C. 水 D.滤液
水 D.滤液
(5)产品的纯度测定:取所得产品10.0 g,配成500 mL溶液,再从中取出25 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050 mol·L-1的标准碘水 溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定化学方程式:
溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定化学方程式:
I2+2Na2S2O3 2NaI+Na2S4O6
2NaI+Na2S4O6
产品中的Na2S2O3·5H2O的纯度为 %。
查看答案和解析>>
科目: 来源: 题型:
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液与“另一物质”在40~50 ℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+ Cu2++Cu。
Cu2++Cu。
根据以上信 息,结合自己所掌握的化学知识,回答下列问题:
息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液与“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作 (填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式: 。
(3)CuH溶解在稀盐酸中生成的气体是 (填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式: 。
查看答案和解析>>
科目: 来源: 题型:
由铝土矿(主要成分是Al2O3)炼制铝的工艺流程示意图如下:

(1)电解生成的铝在熔融液的 (填“上层”或“下层”),电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)写出通入过量二氧化碳酸化时反应的离子方程式: 。
(3)电解制 备铝时,需加入冰晶石(Na3AlF6),其作
备铝时,需加入冰晶石(Na3AlF6),其作 用是 ,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出该反应的化学方程式: 。
用是 ,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出该反应的化学方程式: 。
(4)上述工艺所得铝中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池的阴极材料是 (填化学式),阳极的电极反应为  。
。
(5)对金属制品进行抗腐蚀处理,可延长其使用寿命。
①控制一定条件进行电解(见下图),此时铝表面可形成耐酸的致密氧化膜,其电极反应为 ;

②钢材镀铝后,能防止钢材腐蚀,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
某科研小组以难溶性钾长石(K2O·Al2O3·6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:
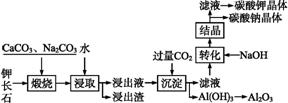
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式: 。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式: 。
(2)已知NaAlO2和KAlO2易发生如下反应:Al+2H2O Al(OH)3+OH-。“浸取”时,应保持溶液呈 (填“酸”或“碱”)性。“浸取”时不断搅拌的目的是 。
Al(OH)3+OH-。“浸取”时,应保持溶液呈 (填“酸”或“碱”)性。“浸取”时不断搅拌的目的是 。
(3)“转化”时加入NaOH的主要作用是 (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是 、 和水。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com