
科目: 来源: 题型:
某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质.
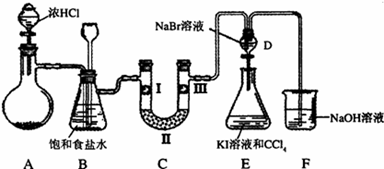
(1)若A装置中固体药品为MnO2,其化学方程式为
若A装置中固体药品为KClO3,则反应中每生成1molCl2时转移电子的物质的量为 mol.
(2)装置B的作用:
(3)装置C的作用是验证氯气是否具有漂白性,l处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是 .
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。但有同学认为该设计不够严密,他的理由可能 。
(5)请用化学方程式说明装置F的作用 。
(6)甲同学提出,装置F中的试剂可改用过量的Na2SO3溶液,乙同学认真思考后认为此法不可行.请用离子方程式解释乙认为不可行的原因:
查看答案和解析>>
科目: 来源: 题型:
次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂。
(l) NaClO2中,氯元素的化合价为________。
(2)某同学在实验室探究并制作一种家用环保型消毒液(NaClO)发生器,设计了如图的装置,用石墨作电极电解饱和氯化钠溶液。
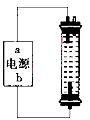
①通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源有b电极名称为_________(填“正”、“负”、“阴”或“阳”)投。
②装置中发生反应的有关化学方程式为________; 充分电解后溶液中各离子浓度由大到小顺序为____________。
③请说出使用该装置生产消毒液的一个优点和一个注意事项____ 。
(3)化学课外活动小组为测定某品牌“84消毒液”中NaClO的含量(单位体积溶液含有 NaCIO的质量),做了如下实验。已知:
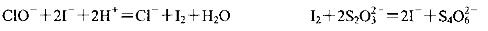
取10 mL该消毒液于锥形瓶中,迅速加入适量的硫酸酸化的碘化钾溶液,密封、充分
混合,暗处放置几分钟。然后加入几滴淀粉溶液,用c mol/L的硫代硫酸钠(Na2S2O3)
标准溶液滴定,平均用去VmL硫代硫酸钠溶液。则该“84消毒液”中NaCIO的含量
为_________g/mL(用含c、V的式子表示)。
(4)以下是过氧化氢法生产亚氯酸钠的工艺流程图:
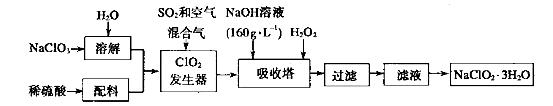
己知:(i)NaClO2 的溶解度随温度升高而增大,适当条件下可结晶析出: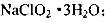
(ii)纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(iii) HClO2可看成是强酸。
①发生器中发生反应的离子方程式为___________________在发生器中鼓入空气的作用可能是__________________。
②吸收塔内的反应的化学方程式为__________________。在吸收塔中为防止被还原成NaCI,所用还原剂的还原性应适中。除外,还可以选择的还原剂_________(填序号)。
A.Na2O2 B.Na2S C.FeCl2
③从滤液中得到 粗晶体的实验操作依次是_________(填序号)。
粗晶体的实验操作依次是_________(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
查看答案和解析>>
科目: 来源: 题型:
氯化溴(BrCl)化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,跟水反应的化学方程式为BrCl+ H2O = HCl+ HBrO,关于BrCl叙述错误的是:( )
A. 固态溴化碘是由极性键构成的分子晶体 B. 和NaOH溶液反应生成NaCl和NaBrO
C. 能使湿润的淀粉碘化钾试纸变蓝 D. 与水反应时BrCl既是氧化剂又是还原剂
查看答案和解析>>
科目: 来源: 题型:
.在化学学习、研究中,类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A. CO2和Na2O2反应生成Na2CO3,推测:SO2和Na2O2反应生成Na2SO3
B.金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭
C. Fe3O4可表示为FeO·Fe2O3,推测:Pb3O4也可表示为PbO·Pb2O3
D. F、Cl、 Br,、I的单质熔点依次升高,推测:N、 P、As、 Sb、Bi单质熔点也依次升高
查看答案和解析>>
科目: 来源: 题型:
下列实验设计和结论相符的是
A.加入NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝气体,则一定含有NH4+
B.将SO2通入溴水,溴水褪色,说明SO2具有漂白性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeC12杂质的FeCl3溶液中通入足里C12后,充分加热除去过量的C12,即可得到较纯净的FeC13溶液
查看答案和解析>>
科目: 来源: 题型:
三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂,三氯异氰尿酸水解生成X和NH4HCO3。下列关于X的说法不正确的是
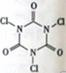
A.X的结构式为H—Cl—O B.X有强氧化性
C.X属于弱酸 D.X属于电解质
查看答案和解析>>
科目: 来源: 题型:
1814年戴维发现了一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物。
(1)氯元素在元素周期表中的位置是_________;ICl的电子式为____________。
(2)ICl与冷的NaOH稀溶液反应的离子方程式为____________________。
(3)用海带制碘时,生成的粗碘中常混有ICl,可加入KI加热升华提纯,发生化学反应的化学方程式为_____________________。
(4)三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的相对质量分别为198和269,其电离方程式为_________________________。下列说法正确的是______。
a.ICl3分子中各原子均达到8电子稳定结构
b.由反应KClO3+I2+6HCl=2ICl3+KCl+3H2O,可知还原性:KClO3>ICl3
c.ICl与乙烯反应的化学方程式为CH2=CH2+ICl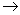 ICH2CH2Cl
ICH2CH2Cl
d.ICl与苯反应制取碘苯的化学方程式为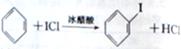
查看答案和解析>>
科目: 来源: 题型:
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示)。下列有关说法错误的是( )
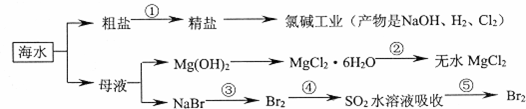
A.从能量转换的角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程
B.过程②中结晶出的MgCl2·6H2O要在HCl的氛围中加热脱水制得无水MgCl2
C.在过程③、⑤中溴元素均被氧化
D.除去粗盐中的SO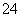 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
科目: 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,发出苍白色火焰,产物溶于水得到一种强酸。回答下列问题:
(1)写出一种工业制备单质F的化学方程式:____________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为___________, 请用离子方程式解释该溶液呈碱性的原因____________________________________________;
(3)实验室用F从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
|
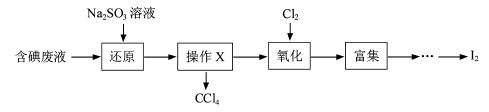
①向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为__________ ;
②操作X的名称为___________________。
③已知:5SO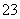 +2IO
+2IO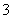 +2H+===I2+5SO
+2H+===I2+5SO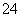 +H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO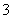 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO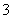 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO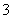 ;若溶液不变蓝,说明废水中不含有IO
;若溶液不变蓝,说明废水中不含有IO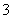 。
。
(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com