
科目: 来源: 题型:
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是( )
A.甲苯与硝酸反应生成三硝基甲苯
B.甲苯能使酸性高锰酸钾溶液褪色
C.甲苯燃烧产生带浓烟的火焰
D.1 mol甲苯与3 mol H2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
已知25℃时,Ksp[Mg(OH)2]=1×10-11 mol3·L-3,如向100 mL 0.1 mol·L-1 MgCl2溶液中加入0.1 mol·L-1 NaOH溶液使Mg2+沉淀,当溶液中[Mg2+]降到1×10-5 mol·L-1时可以认为Mg2+已沉淀完全,问至少需将溶液的pH调节到多少可使Mg2+沉淀完全?消耗NaOH的最小体积为多少?
查看答案和解析>>
科目: 来源: 题型:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较____________(填溶质的化学式)溶液中NH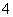 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)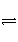
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10 mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为____________(填序号),此时溶液②中Cl-物质的量浓度为______________。
查看答案和解析>>
科目: 来源: 题型:
一种澄清透明的溶液中,可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH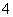 、Cl-、NO
、Cl-、NO 、HCO
、HCO 、SO
、SO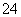 。现做以下实验:
。现做以下实验:
(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2)取少量溶液,加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀;
(3)将(2)中的沉淀过滤,向滤液中加入AgNO3溶液,产生白色沉淀;
(4)另取溶液,逐滴加入NaOH溶液至过量,只看到有红褐色沉淀生成,且沉淀质量不减少。
由此可以推断:
溶液中肯定存在的离子有_________________________________________________;
溶液中肯定不存在的离子有________________________________________________;
溶液中不能确定是否存在的离子有_________________________________________。
SO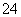 、Fe3+ Ba2+、Al3+、HCO
、Fe3+ Ba2+、Al3+、HCO K+、NH
K+、NH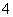 、Cl-、NO
、Cl-、NO
查看答案和解析>>
科目: 来源: 题型:
将0.2 mol·L-1 HA溶液与0.2 mol·L-1 NaOH溶液等体积混合,测得混合溶液中[Na+]>[A-],则(用“>”、“<”或“=”填写下列空白):
(1)混合溶液中[HA]________[A-];
(2)混合溶液中[HA]+[A-]________0.1 mol·L-1;
(3)混合溶液中由水电离出的[OH-]______0.2 mol·L-1 HA溶液中由水电离出的[H+];
(4)25℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度________NaA的水解程度。
查看答案和解析>>
科目: 来源: 题型:
某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是______→______→______→D→______(均用字母填写)。
(2)滴定管的读数应注意
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是
________________________________________________________________________
________________________________________________________________________。
D步骤中液面应调节到
________________________________________________________________________
__________,尖嘴部分应__________________________________________________。
滴定终点时锥形瓶内溶液的pH约为_____________________________________,
终点时颜色变化是_______________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?______(填“偏高”、“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
25℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L溶液。
(1)该溶液中共含有______种不同的微粒(包括分子和离子)。
(2)在这些微粒中,________和________两种微粒的物质的量之和等于0.01 mol。
(3)________和________两种微粒的物质的量之和比H+的物质的量多0.008 mol。
查看答案和解析>>
科目: 来源: 题型:
电离常数(Ka或Kb)、溶度积常数(Ksp)是判断物质性质的重要常数,下列关于这些常数的计算或运用正确的是( )
A.某亚硫酸溶液pH=4.3,若忽略二级电离,则其一级电离平衡常数K1=1.0×10-8.60 mol2·L-2
B.Ka(HCN)<Ka(CH3COOH),说明同浓度时氢氰酸的酸性比醋酸强
C.Ksp(AgI)<Ksp(AgCl),向AgCl悬浊液中加入KI溶液会出现黄色沉淀
D.Ksp(AgCl)<Ksp(AgOH),说明AgOH和AgCl均不溶于稀硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com