
科目: 来源: 题型:
某研究性学习小组探究如下实验:在常温下,取两片质量相等、外形和组成相同且表面经过砂纸打磨完全去掉氧化膜的铝片,分别加入盛有相同体积、H+浓度相同的稀硫酸和稀盐酸的两支大小相同的试管中,发现铝片在稀盐酸中产生氢气的反应速率比在稀硫酸中的快。查阅相关资料后得知:化学反应速率主要由参加反应的物质的性质决定,其次是外界因素的影响。
(1)写出以上反应的离子方程式_______________________________。
(2)出现上述现象的原因可能:假设①SO对铝与H+的反应有抑制作用;假设②___________________________________________________________。
(3)请设计实验对上述假设进行验证:
①____________________________________________;
②____________________________________________。
(4)如果上述假设都成立,要使上述稀硫酸与铝反应产生氢气的速率加快,可以采取的措施有:
①__________________________________________________;
②__________________________________________________;
③__________________________________________________;
④__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O激光TiO22H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,________能转变为________能,二氧化钛作________。生成的氢气用于燃料电池时,________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应如下:
A极:2H2+2O2--4e-===2H2O
B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
查看答案和解析>>
科目: 来源: 题型:
在200 ℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)2HI(g)。
(1)反应刚开始时,由于c(H2)=________,c(I2)=________,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”)。
(3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
查看答案和解析>>
科目: 来源: 题型:
(1)下列反应中,属于放热反应的是________,属于吸热反应的是________。
①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)用铜、银与硝酸银设计一个原电池,此电池的负极是________,负极的电极反应式是_________________________________________________。
(3)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25 g,铜表面析出了氢气________L(标准状况),导线中通过________mol电子。
(4)某化学反应,设反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为________热反应,该反应过程可以看成________________________________________________________________。
中和反应都是________热反应,其实质是__________________________________________________________________
________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)
 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是
( )。
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目: 来源: 题型:
反应C(s)+H2O(g)
 CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
( )。
①增加C的量 ②将容器的体积减小一半 ③保持体积不变,充入氮气使体系的压强增大 ④保持压强不变,充入氮气使体系的体积增大
A.①② B.②③ C.①③ D.③④
查看答案和解析>>
科目: 来源: 题型:
如图所示的装置中,M为金属活动性顺序表中位于氢之前的金属,N为石墨棒,下列关于此装置的叙述中不正确的是
( )。
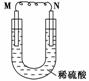
A.N上有气体放出
B.M为负极,N为正极
C.是化学能转变为电能的装置
D.导线中有电流通过,电流方向是由M到N
查看答案和解析>>
科目: 来源: 题型:
在密闭容器中进行反应:X2(g)+3Y2(g)
 2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
( )。
A.c(Z)=0.5 mol·L-1 B.c(Y2)=0.5 mol·L-1
C.c(X2)=0.2 mol·L-1 D.c(Y2)=0.6 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
一定温度下,反应2SO2(g)+O2(g)  2SO3(g),达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是
2SO3(g),达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是
( )。
A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
查看答案和解析>>
科目: 来源: 题型:
下列措施对增大反应速率明显有效的是
( )。
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com