
科目: 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白。过氧化氢法生产亚氯酸钠的流程图如下
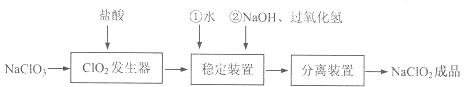
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为
(2)在NaClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂 B.还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验后顺序填写操作代号)。
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO-2能被I完全还原成Cl—;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6。
欲测定成品中NaClO2的含量,现进行如下操作:

①步骤Ⅱ中发生反应的离子方程式是 ,
步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数 (用字母表示)。
查看答案和解析>>
科目: 来源: 题型:
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生 素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:

该工艺的主要流程如下:
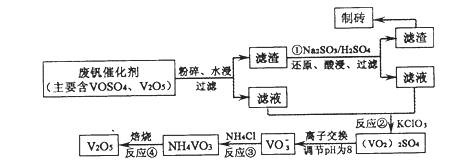
请回答下列问题。
(1)工业上由V2O5冶炼金属钒常用铝热剂法,用化学方程式表示为 。
(2)反应①的目的是 。
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式: 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量:VO2++H2C2O4+H+→VO2++CO2+X。X为 (写化学式)。
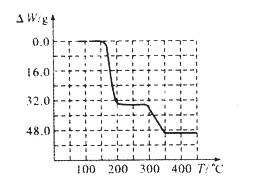
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化 的曲线如上图所示。则NH4VO3在分解过程中 (填序号)。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
查看答案和解析>>
科目: 来源: 题型:
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
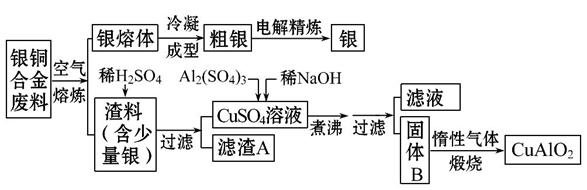
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为__________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为____________
____________________________________________________。
(2)固体混合物B的组成为____________;在生成固体B的过程中,需控制NaOH的加入量。若NaOH过量,则因过量引起的反应的离子方程式为______________
____________________________________________________。
(3)完成煅烧过程中一个反应的化学方程式:
______CuO+____Al2O3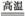 ______CuAlO2+____↑。
______CuAlO2+____↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液____________L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是__________、过滤、洗涤和干燥。
查看答案和解析>>
科目: 来源: 题型:
为提高物质、能源利用率,化学工业近年提出共生工程,工业生产活动应尽可能多功能化。比如以硫酸工业的尾气、氨水、石灰石、焦炭、碳酸氢铵及氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
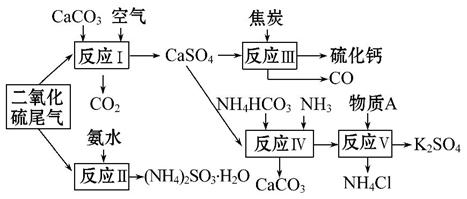
(1)除了可用于制备其他物质,SO2还可用于_________________;
(2)反应Ⅴ的原料A是________(填化学式);
(3)反应Ⅲ生成1 mol CaS转移的电子数为_________________________;
(4)生产中,向反应Ⅱ的溶液中加入适量还原性很强的对苯二酚等物质,其目的是________________________________________。
产物(NH4)2SO3可用于电厂等烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式____________________________________;
(5)反应Ⅳ是往CaSO4悬浊液中加入碳酸氢铵、通入氨气,控制在60℃~70℃左右搅拌,温度太高和太低的不足分别是______________________________。
已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L含CaSO4固体的溶液中加入
2.22 g CaCl2粉末充分搅拌,假设溶液的体积变化忽略不计,所得溶液中c(S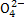 )=__________。
)=__________。
查看答案和解析>>
科目: 来源: 题型:
MgSO4·7H2O在医药上常用作泻药,工业上可用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。其主要工艺如下:
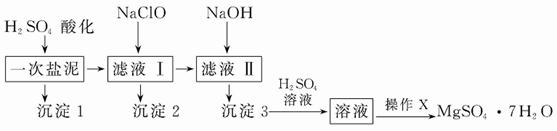
请回答下列问题:
(1)用H2SO4调节溶液pH至1~2,H2SO4的作用是______________________。
(2)加NaClO溶液至pH为5~6并加热煮沸5分钟~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为__________________、________________;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为____
_____________________________________________________。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是________________________。
(4)“操作X”是将溶液____________________、____________________、过滤洗涤,即得到MgSO4·7H2O晶体。
查看答案和解析>>
科目: 来源: 题型:
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。
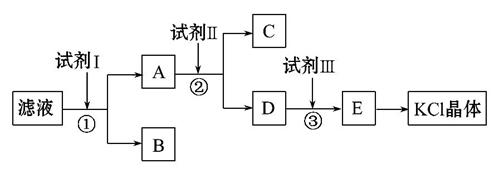
回答下列问题:
(1)起始滤液的pH__________7(填“大于”“小于”或“等于”),其原因是______________________________________________;
(2)试剂Ⅰ的化学式为______________,①中发生反应的离子方程式为______
__________________________________________________________________;
(3)试剂Ⅱ的化学式为______________,②中加入试剂Ⅱ的目的是__________
__________________________________________________________________;
(4)试剂Ⅲ的名称是__________,③中发生反应的离子方程式为___________
__________________________________________________________________;
(5)某同学称取提纯的产品0.775 9 g,溶解后定容在100 mL容量瓶中,每次取25.00 mL溶液,用0.100 0 mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62 mL,该产品的纯度为________(列式并计算结果)。
查看答案和解析>>
科目: 来源: 题型:
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、S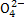 、Br-、C
、Br-、C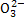 、HC
、HC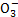 等离子,火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
等离子,火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
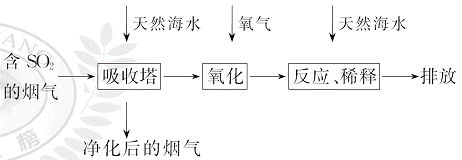
下列说法错误的是( )
A.天然海水pH≈8的原因是海水中的C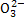 、HC
、HC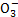 水解
水解
B.“氧化”是利用氧气将HS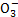 、S
、S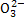 等氧化生成S
等氧化生成S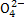
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧气氧化后海水中生成的酸
D.“排放”出来的海水中S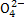 的物质的量浓度与进入吸收塔的天然海水相同
的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
科目: 来源: 题型:
美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(工业流程如图所示)。下列有关该工艺的说法中错误的是( )
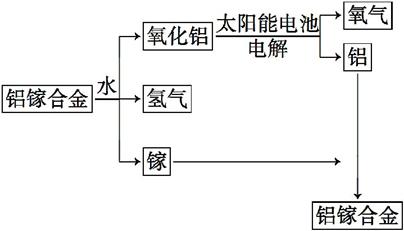
A.该过程能量转化的形式只有两种
B.铝镓合金可以循环使用
C.铝镓合金与水的反应属于置换反应
D.总反应式为:2H2O====2H2↑+O2↑
查看答案和解析>>
科目: 来源: 题型:
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
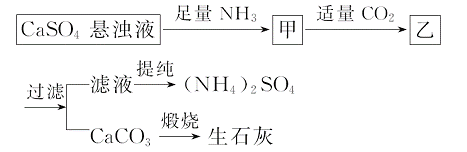
下列推断不合理的是( )
A.直接蒸干滤液得到纯净的(NH4)2SO4
B.生成1 mol(NH4)2SO4至少消耗2 mol NH3
C.CO2可循环使用
D.往甲中通CO2有利于(NH4)2SO4生成
查看答案和解析>>
科目: 来源: 题型:
下列有关化工生产的说法中,不正确的是( )
A.工业上用热还原法冶炼铁:Fe2O3+3CO 3CO2+2Fe
3CO2+2Fe
B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
C.在铁管上镀锌,用铁管作阳极,锌块作阴极
D.利用反应:NaCl(饱和)+CO2+NH3+H2O====NaHCO3↓+NH4Cl制取NaHCO3时,应先通入过量的NH3,再通入过量的CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com