
科目: 来源: 题型:
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH 、Cl-、S2-
、Cl-、S2-
B.0.1 mol·L-1FeCl3溶液中大量存在Fe2+、NH 、SCN-、SO
、SCN-、SO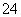
C.0.1 mol·L-1NH4HCO3溶液中:K+、Na+、NO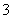 、Cl-
、Cl-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO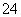
查看答案和解析>>
科目: 来源: 题型:
含有下列各组离子的溶液中通入(或加入)过量的某种物质后仍能大量共存的是
A.H+、Ba2+、Fe3+、NO3-,通入SO2气体
B.Ca2+、Cl-、K+、H+,通入CO2气体
C.AlO2-、Na+、Br-、SO42-,通入CO2气体
D.HCO3-、Na+、I-、HS-,加入AlCl3溶液
查看答案和解析>>
科目: 来源: 题型:
能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O
C.磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:
2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
有一瓶无色溶液,其中可能含有NH4+、K+ 、Mg2+、Ba2+、Al3+ 、Fe3+、I-、Cl-、NO3-、CO32-、SO42-取该溶液进行以下实验:
①该溶液可使pH试纸呈红色;
②取少量溶液加新制氯水及CCl4振荡,可见CCl4层呈现紫色;
③取少量溶液加氯化钡溶液,有白色沉淀生成,加人HNO3后沉淀不溶解;
④取实验③之上层清液,加入硝酸银溶液有白色沉淀生成,加入HNO3后沉淀不溶解;
⑤取少量原溶液加入NaOH溶液呈碱性,在此过程中有白色沉淀生成,而后又逐渐消失,将此溶液加热,有无色气休放出,该气体能使润湿的红色石蕊试纸变蓝。
根据上述实验事实,溶液中肯定存在的离子有_____________________,肯定不存在的离子有_____________________,不能确定是否存在的离子有_________________________。
查看答案和解析>>
科目: 来源: 题型:
某溶液可能含有Cl-、SO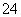 、CO
、CO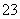 、NH
、NH 、Fe3+、Al3+和K+。取该溶液 100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
、Fe3+、Al3+和K+。取该溶液 100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
A、至少存在5种离子 B、Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
C、SO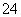 、NH
、NH 一定存在,Cl-可能不存在 D、CO
一定存在,Cl-可能不存在 D、CO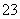 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目: 来源: 题型:
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%)。某同学设计了如下方案,分离样品中各种金属元素。请回答下列问题。
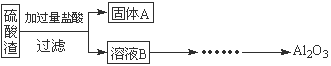
(1)写出溶液B的溶质是 。
(2)参照以下框图形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作) 。
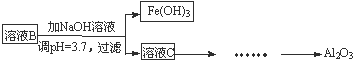
(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。写出反应的离方程式: 。
查看答案和解析>>
科目: 来源: 题型:
可以用金属铝将水体中的NO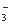 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO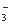 、N2,写出反应的离子方程式 。
、N2,写出反应的离子方程式 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3。电池正极的电极反应式为 。
(3)已知:①4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
②Fe2O3(s)+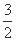 C(s)=
C(s)= 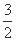 CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
③C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图: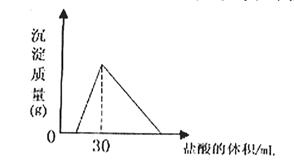 则反应过程中产生氢气的总体积为 L(标准状况)
则反应过程中产生氢气的总体积为 L(标准状况)
查看答案和解析>>
科目: 来源: 题型:
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如图:
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 :
(2)加6%的H2O2时,温度不能过高,其目的是
(3)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀.在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为
(4)上述流程中滤液Ⅲ的主要成分是
(5)操作Ⅰ包括以下过程:过滤,溶解, , ,洗涤获得NiSO4•6H2O晶体
查看答案和解析>>
科目: 来源: 题型:
在水溶液中能大量共存的一组是
A.Ba2+、Na+、SO42—、Cl— B.MnO4—、SO32—、H+、K+
C.AlO2—、Mg2+、K+ 、HCO3— D.K+、 Na+、 NO3— 、SO42—
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式正确的是
A. 铝溶于NaOH溶液:Al+2OH—=AlO2—+H2↑
B. 铜溶于稀硝酸:3Cu+ 8H+ +2NO3—=3Cu2+ +2NO↑ + 4H2O
C. 碳酸镁中滴加稀盐酸:CO32—+2H+ =CO2↑ + H2O
D. 稀硫酸中滴加氢氧化钡溶液:H++ OH—=H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com