
科目: 来源: 题型:
下列叙述错误的是
A、生铁中含有碳,抗腐蚀能力比纯铁弱 B、用锡焊接的铁质器件,焊接处易生锈
C、在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 D、铁管上镶嵌锌块,铁管不易被腐蚀
查看答案和解析>>
科目: 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是
A、晶体硅具有半导体性质,可用于生产光导纤维
B、H2O2是一种绿色氧化剂,可与酸性高锰酸钾作用产生O2
C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸
D、铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式正确的是
A. 铝溶于NaOH溶液:Al+2OH—=AlO2—+H2↑
B. 铜溶于稀硝酸:3Cu+ 8H+ +2NO3—=3Cu2+ +2NO↑ + 4H2O
C. 碳酸镁中滴加稀盐酸:CO32—+2H+ =CO2↑ + H2O
D. 稀硫酸中滴加氢氧化钡溶液:H++ OH—=H2O
查看答案和解析>>
科目: 来源: 题型:
向明矾溶液里滴加Ba(OH)2溶液,当SO42-离子恰好沉淀完全时,铝元素的存在形式是
A.一部分为Al(OH)3沉淀,一部分以Al3+存在于溶液中
B.一部分为Al(OH)3沉淀,一部分以AlO2-形式存在于溶液中
C.全部为Al(OH)3沉淀
D.几乎全部以AlO2-形式存在于溶液中
查看答案和解析>>
科目: 来源: 题型:
(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为________。
(2)向等体积、等浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,则三种溶液的物质的量浓度之比为________。
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗Na、Mg、Al的物质的量之比为________。
(4)足量的Al分别与等浓度的硫酸、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为________。
查看答案和解析>>
科目: 来源: 题型:
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体, C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
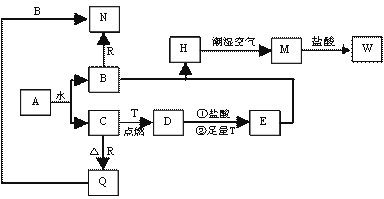
(1)写出下列物质的化学式:
A: D: R: 。
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式: ;
向N中通足量CO2时反应的离子方程式: ;
D与盐酸反应的离子方程式: 。
(3)简述检验气体C的方法: 。
查看答案和解析>>
科目: 来源: 题型:
将总物质的量为4mol的Na2O2和Al2(SO4)3的混合物投入足量水中,充分反应后生成y mol沉淀(y>0)。若以x表示原混合物中Na2O2的物质的量,试建立y=f(x)的函数关系式,将x的取值和y=f(x)关系式填写在表内(可不填满,也可补充)。
| 序号 | x值 | y=f(x) |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4: 。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、 等玻璃仪器。
(2)步骤1发生反应的离子方程式为
过滤的目的是__________________________________________。
(3)当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
(4)步骤2中溶液的pH控制较难操作,可改用____________________,发生反应的离子方程式为 。
(5)步骤4的操作为 。
查看答案和解析>>
科目: 来源: 题型:
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流程进行一系列反应来制备无水AlCl3。
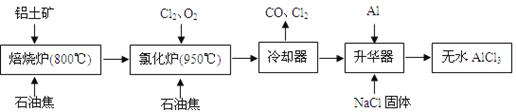
(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是 晶体,其结构式为 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是 。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为: 。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: 。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为: 。
查看答案和解析>>
科目: 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝—冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:2Al2O3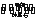 4Al+3O2↑
4Al+3O2↑
加人冰晶石的作用是_____________________。
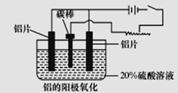
(2)上述工艺所得铝材中往往含有少最Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为_____________,下列可作阴极材料的是____________(填字母序号)。
A.铝材 B.石墨 C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为__________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是______________________________。
(5)下列说法正确的是(填字母序号)。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com