
科目: 来源: 题型:
下列关于有机化学发展史的说法错误的是( )
A.中国科学家成功合成了结晶牛胰岛素,标志着人类合成蛋白质时代的开始
B.德国化学家李比希提出运用同位素示踪法研究化学反应历程
C.瑞典化学家贝采利乌斯提出有机化学的概念,使之成为化学的一个重要分支
D.德国化学家维勒用氰酸铵合成尿素,从而打破了无机物和有机物的界限
查看答案和解析>>
科目: 来源: 题型:
2013年7月四川省部分地区遭遇强降雨天气,当地居民饮用水受到严重污染。高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:

(1)高铁酸钾中铁元素的化合价为________,推测它具有的化学性质是__________________。
(2)在NaClO溶液中加入烧碱固体形成碱性环境,将研磨的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h。发生的离子反应为2Fe3++3ClO-+10OH-===2FeO +3Cl-+5H2O,氧化剂是________。将KOH加入反应后的溶液中搅拌半小时,静置,过滤粗产品,该过程发生的反应为2KOH+Na2FeO4===K2FeO4+2NaOH,根据复分解反应原理,高铁酸钠的溶解度________(填“大于”、“小于”或“等于”)高铁酸钾的溶解度。
+3Cl-+5H2O,氧化剂是________。将KOH加入反应后的溶液中搅拌半小时,静置,过滤粗产品,该过程发生的反应为2KOH+Na2FeO4===K2FeO4+2NaOH,根据复分解反应原理,高铁酸钠的溶解度________(填“大于”、“小于”或“等于”)高铁酸钾的溶解度。
(3)在强碱性溶液中,高铁酸钾能将亚铬酸钾(KCrO2)氧化为铬酸钾(K2CrO4),生成的铬酸盐溶解酸化后,得到的重铬酸钾(K2Cr2O7)用(NH4)2Fe(SO4)2标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价铬),有关反应的离子方程式为FeO +CrO
+CrO +2H2O===CrO
+2H2O===CrO +Fe(OH)3↓+OH-,2CrO
+Fe(OH)3↓+OH-,2CrO +2H+===Cr2O
+2H+===Cr2O +H2O,Cr2O
+H2O,Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O。
+6Fe2++14H+===2Cr3++6Fe3++7H2O。
现称取5.00 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL 容量瓶中,定容,量取25.00 mL,再用稀硫酸酸化,用0.100 0 mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定,消耗标准溶液33.33 mL。计算上述实验制得的样品中高铁酸钾的质量分数。
查看答案和解析>>
科目: 来源: 题型:
工业上从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使之成为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的。生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+被氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂):
NaClO+A+B―→NaCl+C+H2O
NaClO3+A+B―→NaCl+C+H2O
(1)请完成以上化学方程式:________________________________________,________________________________________________。
实际生产中采用NaClO3来氧化Fe2+比较合算,其理由是_________________ _____________________________________________________________________________________________________________________________。
(2)配平下列离子方程式,并回答问题。
 Fe(OH)3+
Fe(OH)3+ ClO-+
ClO-+ OH-===
OH-=== FeO
FeO +
+ Cl-+
Cl-+ H2O
H2O
(3)已知有3.21 g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=________。
(4)根据上述(2)(3)题推测FeO 能与下列哪些物质反应________(只填序号)。
能与下列哪些物质反应________(只填序号)。
A.Cl2 B.SO2
C.H2S D.O2
查看答案和解析>>
科目: 来源: 题型:
KMnO4是一种典型的强氧化剂。请回答下列问题:
(1)实验室中可用已知浓度的酸性高锰酸钾溶液滴定含Fe2+的溶液,从而测定溶液中Fe2+的浓度,离子反应方程式如下,请在空格内填上缺少的反应物,并配平:
Fe2++____MnO +____
+____ ===____Fe3++____Mn2++____H2O
===____Fe3++____Mn2++____H2O
(2)在稀硫酸中,MnO 和H2O2也能发生氧化还原反应:
和H2O2也能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
①写出该氧化还原反应的化学方程式:________________________________。
反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。
②实验中发现,当加入的少量KMnO4完全反应后,H2O2仍能发生反应快速放出气体。其可能的原因是___________________________________________ _________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
向某FeBr2溶液中通入1.12 L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3 mol·L-1。反应过程中溶液的体积变化不计。则下列说法中正确的是 ( )。
A.原溶液的浓度为0.1 mol·L-1
B.反应后溶液中c(Fe3+)=0.1 mol·L-1
C.反应后溶液中c(Fe3+)=c(Fe2+)
D.原溶液中c(Br-)=0.4 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为SO2+2Fe3++2H2O===SO +2Fe2++4W ①,Cr2O
+2Fe2++4W ①,Cr2O +aFe2++bH+―→Cr3++Fe3++H2O ②。下列有关说法正确的是 ( )。
+aFe2++bH+―→Cr3++Fe3++H2O ②。下列有关说法正确的是 ( )。
A.还原性:Cr3+>SO2
B.方程式②中,a=6,b=7
C.Cr2O 能将Na2SO3氧化成Na2SO4
能将Na2SO3氧化成Na2SO4
D.方程式①中W为OH-
查看答案和解析>>
科目: 来源: 题型:
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列方框中对应的物质或有关叙述正确的是 ( )。
 +
+ +
+ ―→
―→ +
+ +
+
A.Na2S4O6、H2O、Na2S2O3、Au2O、NaOH
B.Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C.Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
D.当1 mol Au2O3完全反应时,转移电子8 mol
查看答案和解析>>
科目: 来源: 题型:
某含铬(Cr2O )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3,不考虑处理过程中的实际损耗,下列叙述错误的是 ( )。
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3,不考虑处理过程中的实际损耗,下列叙述错误的是 ( )。
A.消耗硫酸亚铁铵的物质的量为n(2-x)mol
B.处理废水中Cr2O 的物质的量为
的物质的量为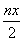 mol
mol
C.反应中发生转移的电子总物质的量为3nxmol
D.在FeO·FeyCrxO3中,3x=y
查看答案和解析>>
科目: 来源: 题型:
向21.6 g铁粉和铜粉的混合物中加入1 L 1 mol·L-1硝酸溶液,充分反应,放出NO气体且金属有剩余。则反应后溶液中c(NO )可能为(忽略溶液体积的变化) ( )。
)可能为(忽略溶液体积的变化) ( )。
A.0.45 mol·L-1 B.0.6 mol·L-1
C.0.75 mol·L-1 D.0.9 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
O3具有强氧化性,将O3通入KI溶液中发生反应:O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是 ( )。
A.配平后的离子方程式为2O3+2I-+4H+===I2+2O2+2H2O
B.每生成1 mol I2转移电子2 mol
C.O2是还原产物之一
D.该反应能说明O2的氧化性大于I2的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com