
科目: 来源: 题型:
室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中至管内水面不再上升;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧,则a、b、c的关系是 ( )。
A.a=4b+3c B.a=4b+c
C.a∶b=4∶1 D.a∶b=4∶3
查看答案和解析>>
科目: 来源: 题型:
有关氨的说法不正确的是 ( )。
A.NH3是4核10电子分子,具有还原性
B.NH3极易溶于水,可做喷泉实验,氨气易液化,液氨可用作制冷剂
C.氨气是非电解质,NH3·H2O是电解质
D.蘸有浓盐酸的玻璃棒遇氨气产生的白烟为二者挥发产生的酸雾
查看答案和解析>>
科目: 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq)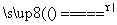 Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________,则整个装置气密性良好。装置D的作用是_______ _______________________________________________________________。
装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是____________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是_____________ ___________________________________________________________。
反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有 ________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:
_____________________________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O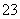 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3 溶液
查看答案和解析>>
科目: 来源: 题型:
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2:4FeS2+11O2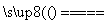 8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)
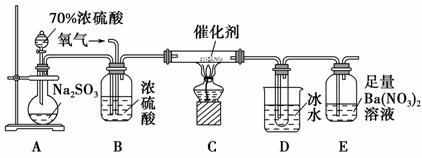
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:________________________________________。
②实验过程中,需要通入氧气。试写出一个用如下图所示装置制取氧气的化学方程式:______________________________________。

③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是___________________________________________________________。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是________(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
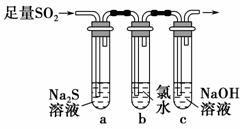
①能说明二氧化硫具有氧化性的实验现象为_______________________ ________________________________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水后所得到的溶液中,得NaHSO3溶液。
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。
(Ⅲ)将盐酸加入NaHSO3溶液中,反应所得到的SO2气体回收,生成的NaCl循环利用。
①写出步骤(Ⅰ)反应的化学方程式:_________________________ _____________________________________________________。
②写出步骤(Ⅱ)中电解饱和食盐水的化学方程式:________________ ______________________________________________________________。
③写出步骤(Ⅲ)反应的离子方程式:_____________________________。
(2)还有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO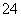 而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO
而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO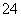 的转化率。
的转化率。

①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是________。(填写序号)
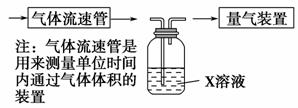
A.碘的淀粉溶液 B.酸性高锰酸钾溶液
C.氢氧化钠溶液 D.氯化钡溶液
②若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO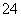 的转化率,已知气体流速,还需测定的数据有____________________________、_________________________。
的转化率,已知气体流速,还需测定的数据有____________________________、_________________________。
查看答案和解析>>
科目: 来源: 题型:
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1。下列叙述不正确的是 ( )。
A.反应中共消耗1.8 mol H2SO4
B.气体甲中SO2与H2的体积比为4∶1
C.反应中共消耗97.5 g Zn
D.反应中共转移3 mol电子
查看答案和解析>>
科目: 来源: 题型:
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是 ( )。
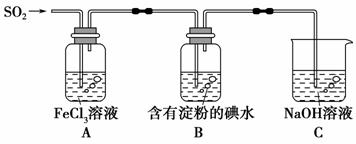
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
查看答案和解析>>
科目: 来源: 题型:
在某溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸,沉淀不溶解,则下列关于该溶液所含离子的推断中正确的是 ( )。
A.一定会有SO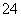
B.含有SO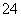 和Ag+
和Ag+
C.可能含有SO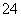 、Ag+、SO
、Ag+、SO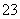 中的一种、两种或三种
中的一种、两种或三种
D.可能含有SO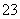 或CO
或CO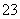
查看答案和解析>>
科目: 来源: 题型:
硫酸、亚硫酸和氢硫酸是含硫的三种酸。下列说法不正确的是 ( )。
A.若向Na2S溶液中通入SO2则产生淡黄色沉淀
B.这三种酸都是二元酸,都能与氢氧化钠反应生成酸式盐和正盐
C.这三种酸的水溶液久置空气中都会变质且原溶质的浓度减小
D.向氢硫酸、亚硫酸溶液中滴加氯水都会发生氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
在实验探究课上,同学们积极思考,共设计出如图所示的四种实验方案用以验证浓硫酸的吸水性,其中在理论上可行的是 ( )。
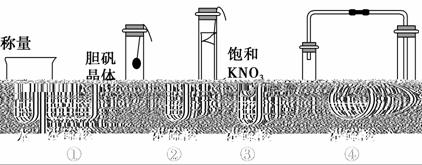
A.①②③④ B.仅①③④
C.仅①②④ D.仅②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com