
科目: 来源: 题型:
下列化学实验基本操作正确的是
A.用手直接拿取砝码
B.用嘴吹灭酒精灯
C.用洁净的玻璃棒蘸取待测液滴在pH试纸上测pH
D.配制溶液时仰视读量筒内液体体积
查看答案和解析>>
科目: 来源: 题型:
具有“天下第一洞”美誉的织金洞是毕节市人民的骄傲,每年 吸引无数海内外游客前来观光,其中最具魅力的是洞内形态各异
吸引无数海内外游客前来观光,其中最具魅力的是洞内形态各异 的钟乳石,它的主要成分为碳酸钙,试问碳酸钙属于哪类物质
的钟乳石,它的主要成分为碳酸钙,试问碳酸钙属于哪类物质
A.酸 B.碱 C.盐 D.氧化物
查看答案和解析>>
科目: 来源: 题型:
分子、原子等粒子构成物质。用我们所学的分子、原子的相关知识解释下列现象,正确
的是
A.墙内开花墙外香,是由于分子在不断运动
B.冰冻三尺非一日之寒,水结冰时,分子静止不动
C.空气中的氧气、二氧化碳气经混合,它们的化学性质改变
D.经过液化、蒸发从空气 中得到氮气和氧气的过程属于化学变化
中得到氮气和氧气的过程属于化学变化
查看答案和解析>>
科目: 来源: 题型:
I.在500 ℃、2×107 Pa和催化剂条件下合成氨工业的核心反应是:N2(g)+3H2(g)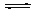 2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
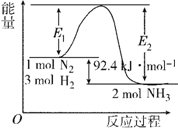
(1) 在500 ℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_____(填“<”“>”或“=”)46.2 kJ,理由是_____________________。
(2) 将一定量的H2(g)和N2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。则该条件下达到平衡时H2的转化率为________。该温度下的平衡常数K的值为________。若升高温度,K值________(填“增大”“减小”或“不变”)。
II.一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s) + H2O(g) 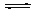 CO(g) + H2(g)
CO(g) + H2(g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均分子量为M,则M的范围为
(2)在(1)中若起始时充入的是2.5 molCO(g) 和4 mol H2(g),达到平衡后混合气体的平均相对分子质量为 。
查看答案和解析>>
科目: 来源: 题型:
有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图: ____________________________。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示)。下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物对应的水化物的碱性比Z强
(3)写出T与Y形成的化合物的化学式_________________,_________________。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:______________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ。则三者的由小到大关系是________(用Q1、Q2、Q3表示)。
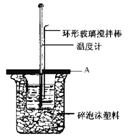 (2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是____________________________; 若实验中不加盖泡沫塑料板,则求得的中和热数值 (填偏大、偏小、无影响)
(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是____________________________; 若实验中不加盖泡沫塑料板,则求得的中和热数值 (填偏大、偏小、无影响)
(3)实验室用50mL 0.50mol·L-1盐酸、50mL 0.55mol·L-1NaOH溶液利用上图装置,进行测定中和热的实验。假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
A.反应前盐酸的温度 B.反应前盐酸的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
依据该学生的实验数据计算,该实验测得的中和热ΔH为________。(保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
如图是某同学设计的一个简易的原电池装置,回答下列问题。
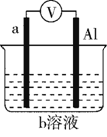
(1)若a为镁、b为CuCl2,则正极材料为_____,负极上的电极反应式为_________。
(2)若a为镁、b为NaOH,则Mg极上发生________反应(填“氧化”或“还原”),负极上的电极反应式为___________________。
(3)若a为铜、b为浓硝酸,则电流的方向为____ →___(填电极材料),正极上的电极反应式为___________。
(4)上述事实表明,确定原电池中电极的正负时,不仅要考虑电极材料本身的性质,还要考虑_____________________________。
查看答案和解析>>
科目: 来源: 题型:
可逆反应①X(g)+2Y(g) 2Z(g)②2M(g)
2Z(g)②2M(g) N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示(隔板两侧反应室温度相同)。下列判断正确的是:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示(隔板两侧反应室温度相同)。下列判断正确的是:

A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(I)时X的转化率为5/11
D.在平衡(I)和平衡(II)中M的体积分数相同
查看答案和解析>>
科目: 来源: 题型:
室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1;将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)  CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com