
科目: 来源: 题型:
下列关于金属键的叙述中,不正确的是 ( )。
A.金属键是金属阳离子和自由电子这两种带异性电荷的微粒间的强烈相互
作用,其实质与离子键类似,也是一种电性作用
B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所
以与共价键类似,也有方向性和饱和性
C.金属键是带异性电荷的金属阳离子和自由电子间的相互作用,故金属键
无饱和性和方向性
D.构成金属键的自由电子在整个金属内部的三维空间中做自由运动
查看答案和解析>>
科目: 来源: 题型:
消毒剂在生产生活中有极其重要的作用,开发具有广谱、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________ (填序号)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O+H2O2===A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是_________________________________________。
(3)漂白剂亚氯酸钠(NaClO2)在常温下、黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子数约为________。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是__________________________________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:______________________________。
查看答案和解析>>
科目: 来源: 题型:
高铁酸钠(Na2FeO4)是一种新型消毒剂,工业上制备高铁酸钠有下列四种方法:
a.2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3NaCl+5H2O;
b.2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑;
c.Fe2O3+3Na2O2===2Na2FeO4+Na2O;
d.Fe(NO3)3+NaOH+Cl2―→Na2FeO4+NaNO3+NaCl+H2O。
请回答下列问题:
(1)下列判断正确的是________(填序号)。
A.方法a、b、c都可在水溶液中进行
B.根据a、b可知NaClO、Na2O2的氧化性均强于Na2FeO4的
C.FeSO4只有还原性,没有氧化性
D.能用KSCN溶液检验b的产物中是否含有FeSO4
(2)对于方法c下列说法正确的是________(填序号)。
A.Na2O2既是氧化剂又是还原剂
B.还原产物只有Na2O
C.3 mol Na2O2发生反应,有6 mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
(3)对于方法d,请回答下列问题:
①氧化剂与还原剂的物质的量之比为________。
②写出Na2FeO4与H2O反应的离子方程式:____________________________,
请你推测Na2FeO4除了能消毒杀菌外,另一个用途是____________________。
查看答案和解析>>
科目: 来源: 题型:
高锰酸钾分别在酸性、中性、碱性条件下发生的反应如下:
MnO +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
MnO +3e-+2H2O===MnO2↓+4OH-
+3e-+2H2O===MnO2↓+4OH-
MnO +e-===MnO
+e-===MnO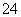 (溶液呈绿色)
(溶液呈绿色)
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的________影响。
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为________________________________________________________。
(3)将PbO2投入酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________(填序号)。
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.MnSO4溶液可以用盐酸酸化
查看答案和解析>>
科目: 来源: 题型:
根据表中信息判断,下列选项正确的是 ( )。
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4…… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO | Cl2、Mn2+…… |
A.第①组反应的其余产物为H2O
B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1∶2
C.第③组反应中生成1 mol Cl2,转移电子5 mol
D.氧化性由强到弱的顺序为MnO >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目: 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是 ( )。
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol
查看答案和解析>>
科目: 来源: 题型:
锑(Sb)在自然界一般以硫化物的形式存在。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
2Sb2S3+3O2+6Fe===Sb4O6+6FeS ①
Sb4O6+6C===4Sb+6CO ②
关于反应①、反应②的说法正确的是 ( )。
A.反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3 mol FeS时,共转移6 mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成1 mol Sb时,反应①与反应②中氧化剂的物质的量之比为1∶3
查看答案和解析>>
科目: 来源: 题型:
在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO 、Fe2+、NH
、Fe2+、NH 、H+、H2O,下列叙述正确的是 ( )。
、H+、H2O,下列叙述正确的是 ( )。
A.该反应说明Fe(NO3)2溶液不宜加酸酸化
B.该反应中氧化剂与还原剂物质的量之比为8∶1
C.若有1 mol NO 发生氧化反应,转移电子5 mol
发生氧化反应,转移电子5 mol
D.若将该反应设计成原电池,则负极反应为Fe3++e-===Fe2+
查看答案和解析>>
科目: 来源: 题型:
PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3∶2。则剩余固体的组成及物质的量之比是 ( )。
A.1∶1混合的Pb3O4、PbO
B.1∶2混合的PbO2、Pb3O4
C.1∶4∶1混合的PbO2、Pb3O4、PbO
D.1∶4∶1混合的PbO2、Pb3O4、PbO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com