
科目: 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) ΔH>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是 ( )。

| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目: 来源: 题型:
在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1)该反应的平衡常数表达式为________;从表中分析:
c1________c2,c3________c4(填“>”、“<”或“=”)。
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1。
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母序号)。
A.扩大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为________。
查看答案和解析>>
科目: 来源: 题型:
(1)反应Fe(s)+CO2(g)FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)FeO(s)+H2(g) ΔH2,平衡常数为K2
在不同温度时K1、K2的值如下表:
| 700 ℃ | 900 ℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:

①该条件下反应的平衡常数为________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为________mol·L-1。
②下列措施中能使平衡时 增大的是________(填序号)。
增大的是________(填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目: 来源: 题型:
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
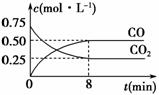
(1)该反应的平衡常数表达式K=________。
(2)下列措施中能使平衡常数K增大的是________(填序号)
A.升高温度 B.增大压强
C.充入一定量CO D.降低温度
(3)8 min内,CO的平均反应速率v(CO)=________mol·L-1·min-1。
(4)1 100 ℃时,2 L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3 mol Fe、2 mol CO2 | 4 mol FeO、3 mol CO |
| CO的浓度(mol·L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
①下列说法正确的是________。
A.2c1=3c2 B.φ1=φ2
C.p1<p2 D.α1=α2
②求c1=________、φ1=________、α2=________。
查看答案和解析>>
科目: 来源: 题型:
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是 ( )。
A.上述生成Ni(CO)4的反应为放热反应
B.25 ℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时
v正>v逆
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol
·L-1
查看答案和解析>>
科目: 来源: 题型:
已知反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )。
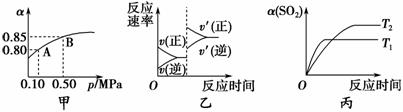
A.由图甲推断,B点SO2的平衡浓度为0.3 moL·L-1
B.由图甲推断,A点对应温度下的平衡常数为80
C.达到平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时,不同温度下SO2的平衡转化率与温度关系如图丙,则T2>T1
查看答案和解析>>
科目: 来源: 题型:
已知:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41 kJ
·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| CO | H2O | CO2 | H2 | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是 ( )。
A.容器①中反应达到平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①中CO反应速率等于H2O的反应速率
查看答案和解析>>
科目: 来源: 题型:
室温下,体积为2 L的密闭容器中A、B、C三种气体的起始浓度和平衡浓度如下表:
| 物质 | A | B | C |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法中正确的是 ( )。
A.发生的反应可表示为A+B2C
B.反应达到平衡时B的转化率为25%
C.若起始时密闭容器中有0.1 mol A、0.1 mol B、0.2 mol C时,反应达平衡时,c(A)=0.05 mol·L-1
D.改变起始时容器中各气体的物质的量,可以改变此反应的平衡常数
查看答案和解析>>
科目: 来源: 题型:
高温及催化剂作用下,某反应的平衡常数K= 。恒容时,温度升高,H2浓度减小,下列说法正确的是 ( )。
。恒容时,温度升高,H2浓度减小,下列说法正确的是 ( )。
A.恒温下,将容器体积变为原来2倍,CO的平衡浓度变为原来的1/2
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,正反应速率减小,逆反应速率增大
D.该反应化学方程式为CO2+H2 CO+H2O ΔH<0
CO+H2O ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com