
科目: 来源: 题型:
有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题。
(1)A是________,B是________,C是________,E是________。
(2)B在周期表中位于________区。
(3)写出C元素基态原子的电子排布式________。
(4)用轨道表示式表示D元素原子的价电子构型_____________。
查看答案和解析>>
科目: 来源: 题型:
(1)A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期表中的位置如图所示:
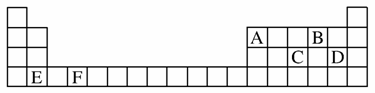
①写出F的基态原子的核外电子排布式:___________________________________________
________________________________________。
②C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是____________________。
(2)A、B、C 3种元素中,A的第一电离能最小,C的电负性最大,3种元素的失电子能力由强到弱的顺序为
___________________________________________。
(3)D、E两种元素形成的化合物化学式为____________________。
查看答案和解析>>
科目: 来源: 题型:
下列给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
请运用元素周期律知识完成下列各题。
(1)同一周期中,从左到右,元素的电负性逐渐________;同一主族中,从上到下,元素的电负性逐渐________。所以,元素的电负性随原子序数的递增呈________变化。
(2)短周期元素中,由电负性最大的元素与电负性最小的元素形成的化合物的化学式为________,用电子式表示该化合物的形成过程:____________________________________。
(3)表中符合“对角线规则”的元素有Li和________、Be和________、B和________,它们的性质分别有一定的相似性,其原因是____________________,写出Be(OH)2与强酸及强碱反应的离子方程式:____________________________________。
(4)一般认为,两成键元素间电负性差值大于1.7时形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。判断Mg3N2、SO2、AlCl3、CS2、MgO是离子化合物还是共价化合物。
离子化合物___________________________________________
共价化合物___________________________________________
查看答案和解析>>
科目: 来源: 题型:
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,哪些违反了泡利原理________,哪些违反了洪特规则________。

(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________;其最高价氧化物对应水化物的化学式是________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是______________________。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为________,其气态氢化物化学式为________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,其最高价氧化物的水化物的化学式为________,C的元素符号为________,C在周期表中的位置为________。
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为________,其基态原子的电子排布式为______________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为________。
查看答案和解析>>
科目: 来源: 题型:
下列关于主族元素电子排布特征的说法正确的是( )
A.主族元素的原子核外电子最后填入的能级是s能级
B.主族元素的原子核外电子最后填入的能级是s能级或p能级
C.主族元素的原子核外电子最后填入的能级是d能级或f能级
D.主族元素的原子核外电子最后填入的能级是s能级或d能级
查看答案和解析>>
科目: 来源: 题型:
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
查看答案和解析>>
科目: 来源: 题型:
从①P和S;②Mg和Ca;③Al和Si三组原子中,分别找出第一电离能较大的原子,将这3种原子的原子序数相加,其和是( )
A.40 B.41 C.42 D.48
查看答案和解析>>
科目: 来源: 题型:
下列元素性质的递变规律正确的是( )
A.原子半径:Be<B<C<N
B.第一电离能:B<Be<Mg<Na
C.元素的电负性:O>N>S>P
D.气态氢化物的稳定性:NH3<CH4<PH3<SiH4
查看答案和解析>>
科目: 来源: 题型:
具有下列电子排布式的原子中,原子半径最大的是( )
A.1s22s22p62s23p2 B.1s22s22p63s2
C.1s22s22p2 D.1s22s22p63s23p4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com