
科目: 来源: 题型:
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应: _______________________________________________;
银片上发生的电极反应: ________________________________________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023 mol-1,电子电量为1.60×10-19C)
查看答案和解析>>
科目: 来源: 题型:
用下图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:
| 组 | A槽 | B槽 |
| 1 | NaOH | CuSO4 |
| 2 | AgNO3 | CuCl2 |
| 3 | Na2SO4 | AgNO3 |
| 4 | NaCl | AgNO3 |
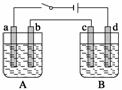
①工作一段时间后,A槽pH上升,B槽的pH下降;
②b、c两极上反应的离子的物质的量相等。
(1)应选择的电解质是上述四组中的第____组。
(2)该组电解过程中各电极上的电极反应为
a极: ________________________________________________________________,
b极: ________________________________________________________________,
c极: ________________________________________________________________,
d极: ________________________________________________________________。
(3)当b极上析出7.1 g电解产物时,a极上析出产物的质量为________ g;若B槽电解质溶液为500 mL,且忽略电解前后电解液的体积变化,则此时B槽中的c(H+)比电解前增加了
________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
为省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液(直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器用品)以巧妙的构思“接力”的方式,设计了比较铜与锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),小心向烧杯中加入稀硫酸,观察到的现象是___________________________________________________
________________________________________________________________________。
甲同学的设计思路是__________________________________________________
________________________________________________________________________。
(2)乙同学接着甲的实验,向烧杯中滴加________溶液,进而观察到的现象是________________________________________________________________________
________________________________________________________________________。
乙同学判断出锌、铜金属活动性相对强弱,所依据的原理是
________________________________________________________________________
________________________________________________________________________。
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂(作为电解液),反应在调控下随即开始,实验中有关的化学反应方程式为________________________________________________________________________
________________________________________________________________________。
获得的实验明显现象是_______________________________________________
________________________________________________________________________。
(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌和铜的金属活动性的相对强弱(简要说明操作和现象)________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
已知下列热化学方程式:
①H2(g)+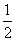 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+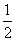 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+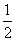 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
回答下列各问题:
(1)上述反应中属于放热反应的是__________________________________________。
(2)H2的燃烧热为________;C的燃烧热为________。
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热为________;其热化学方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
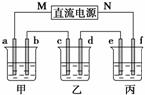
(1)接通电源,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为__________________________________________;
③列式计算电极b上生成的气体在标准状况下的体积:________L;
④电极c的质量变化是__________g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液________________;乙溶液________________;丙溶液________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
查看答案和解析>>
科目: 来源: 题型:
某学习小组设计以下实验,探究化学反应中的热效应,把试管放入盛有25 ℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管向其中滴加5 mL盐酸。试回答下列问题:
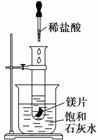
(1)实验中观察到的现象是________________________________________________________________________
________________________________________________________________________。
(2)产生上述现象的原因是________________________________________________________________________
________________________________________________________________________。
(3)写出有关反应的离子方程式:________________________________________________________________________。
(4)由实验推知,MgCl2和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(5)如果将本题中“25 ℃的饱和石灰水”换成“20 ℃碳酸饮料”进行实验探究,实验中观察到的另一现象是______________________________________________________,
其原因是____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g·cm3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是( )
| NaOH的质量分数 | 阳极析出物的质量/g | 阴极析出物的质量/g | |
| A | 6.2% | 19 | 152 |
| B | 6.2% | 152 | 19 |
| C | 4.2% | 1.2 | 9.4 |
| D | 4.2% | 9.4 | 1.2 |
查看答案和解析>>
科目: 来源: 题型:
关于下图所示装置的判断,叙述正确的是( )
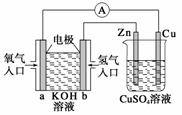
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中的电子流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
科目: 来源: 题型:
以NA代表阿伏加德罗常数,则关于热化学方程式:
C2H2(g)+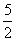 O2(g)===2CO2(g)+H2O(l)
O2(g)===2CO2(g)+H2O(l)
ΔH=-1 300 kJ·mol-1的说法中,正确的是( )
A.当有10NA个电子转移时,该反应放出1 300 kJ的能量
B.当有1NA个水分子生成且为液体时,吸收1 300 kJ的能量
C.当有2NA个碳氧共用电子对生成时,放出1 300 kJ的能量
D.当有10NA个碳氧共用电子对生成时,放出1 300 kJ的能量
查看答案和解析>>
科目: 来源: 题型:
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是( )
A.负极发生的反应为Fe-2e-===Fe2+
B.正极发生的反应为2H2O+O2+2e-===4OH-
C.原电池是将电能转化为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com