
科目: 来源: 题型:
合成氨工业中,原料气(N2、H2、混有少量CO、NH3)在进入合成塔之前,常用醋酸二氨合铜(Ⅰ)溶液来吸收CO,其反应为CH3COO[Cu(NH3)2]+CO+NH3
CH3COO[Cu(NH3)3]·CO(正反应为放热反应)。
(1)必须除去CO的原因是_______________________________________。
(2)醋酸二氨合铜(Ⅰ)溶液吸收原料气中CO的适宜条件是
____________________________________________________。
(3)吸收CO后的醋酸铜(Ⅰ)氨溶液经适当处理又可再生,恢复其吸收CO的能力而循环使用,其再生的条件是______________________________。
查看答案和解析>>
科目: 来源: 题型:
合成NH3所需的H2可由煤与H2O反应制得,其中有一步反应为CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0。欲提高CO转化率可采用的方法可能有:①降低温度;②增大压强 ③使用催化剂 ④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是 ( )。
A.①②③ B.④⑤
C.①⑤ D.⑤
查看答案和解析>>
科目: 来源: 题型:
合成氨时既要使氨的产率增大,又要使反应速率加快,可采取的办法是
( )。
①减压 ②加压 ③升温 ④降温 ⑤及时从平衡混合气中分离出NH3
⑥补充N2或H2 ⑦加催化剂 ⑧减小N2或H2的量
A.③④⑤⑦ B.①②⑤⑥
C.②⑥ D.②③⑥⑦
查看答案和解析>>
科目: 来源: 题型:
下列关于合成氨工业的叙述可用勒夏特列原理来解释的是 ( )。
A.使用铁触媒,使平衡向生成NH3的方向移动
B.高压比常压条件更有利于合成氨的反应
C.500 ℃左右比室温更有利于合成氨的反应
D.合成氨时采用循环操作可提高原料的利用率
查看答案和解析>>
科目: 来源: 题型:
下列有关合成氨工业的说法中,正确的是 ( )。
A.从合成塔出来的混合气体中,氨气占15%,所以生产氨的工厂的效率都
很低
B.由于氨易液化,N2和H2在实际生产中循环使用,所以总体来说,氨的产
率很高
C.合成氨工业的反应温度控制在500 ℃,目的是使化学平衡向正反应方向
移动
D.我国合成氨厂采用的压强是10~30 MPa,因为该压强下铁触媒的活性最
大
查看答案和解析>>
科目: 来源: 题型:
为了进一步提高合成氨的生产效率,科研中具有开发价值的是 ( )。
A.研制高温下活性较大的催化剂
B.寻求NH3的新来源
C.研制低温下活性较大的催化剂
D.研制耐高温高压的新型材料建造合成塔
查看答案和解析>>
科目: 来源: 题型:
T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:
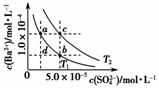
(1)T1________T2(填“>”、“<”或“=”),T2时Ksp(BaSO4)=________。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是________(填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是___________________________________________________________
__________________________________________________________________
(用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol
·L-1 Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________ mol·L-1。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
以下是25 ℃时几种难溶电解质的溶解度:
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤,结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤,结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为________(填名称)而除去。
(2)①中加入的试剂应选择________为宜,其原因是_________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为_______________________
_________________________________________________________________。
(4)下列关于方案③相关的叙述中,正确的是________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目: 来源: 题型:
请按要求回答下列问题:
(1)已知25 ℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为____________________________。
(2)25 ℃时,向0.01 mol·L-1的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为________;当Mg2+完全沉淀时,溶液的pH为________(忽略溶液体积变化,已知lg 2.4=0.4,lg 7.7=0.9)。
(3)已知25 ℃时,Ksp(AgCl)=1.8×10-10,则将AgCl放在蒸馏水中形成饱和溶液,溶液中的c(Ag+)约为______ mol·L-1。
(4)已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com