
科目: 来源: 题型:
下列离子方程式不正确的是
A. 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3===2Cu2++CO2↑+3H2O
B. 将Na2O2固体投入H218O中:2H218O+2Na2O2===4OH-+4Na++18O2↑
C. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO 完全沉淀:
完全沉淀:
2Ba2++NH +Al3++2SO
+Al3++2SO +4OH-===Al(OH)3↓+NH3·H2O+2BaSO4↓
+4OH-===Al(OH)3↓+NH3·H2O+2BaSO4↓
D. 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO +20H+===4Fe3++3O2↑+10H2O
+20H+===4Fe3++3O2↑+10H2O
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A. 氯水和过氧化钠都具有漂白作用,其漂白原理相似
B. 硅和二氧化硅都是重要的半导体材料
C. 蛋白质和油脂的水解都是由高分子化合物生成小分子化合物的过程
D. MgO和Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼镁、铝金属
查看答案和解析>>
科目: 来源: 题型:
下列有关化学用语以及化学基本概念的表述中正确的一组是
A. 过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同,两者互为同分异构体
B. 日本福岛核电站泄露的放射性核素 Ⅰ和
Ⅰ和 Cs,前者比后者少4个中子
Cs,前者比后者少4个中子
C. 亚硫酸氢钠和碳酸氢钠的电离方程式都表示为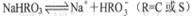
D. 次氯酸的结构式为HOCl,过氧化氢的电子式为
查看答案和解析>>
科目: 来源: 题型:
“绿色化学”又称环境无公害化学。下列叙述符合“绿色化学”原则的是
A. 绿色化学的核心是利用化学原理对工业生产造成的环境污染进行治理
B. 用聚苯乙烯等塑料代替木材生产包装盒、快餐盒等,以减少木材使用
C. 研制新型杀虫剂,使它只对目标昆虫有毒杀作用而对其他昆虫无害
D. 现代石油化工采用银作催化剂,将乙烯直接氧化生产环氧乙烷符合“原子经济”
查看答案和解析>>
科目: 来源: 题型:
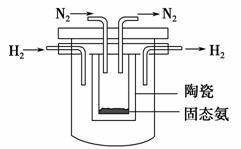
如图所示“合成氨”的演示实验(夹持仪器均已省略)。在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和NH4Cl饱和溶液反应制取N2,N2和H2混合后通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,则说明产生了氨气。

某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一:NaNO2固体和饱和NH4Cl溶液混合加热的过程中发生如下反应:
①NaNO2+NH4Cl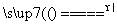 NH4NO2+NaCl
NH4NO2+NaCl
②NH4NO2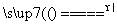 NH3↑+HNO2
NH3↑+HNO2
③2HNO2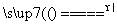 N2O3↑+H2O
N2O3↑+H2O
④2NH3+N2O3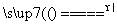 2N2+3H2O
2N2+3H2O
信息二:查阅资料,不同体积比的N2、H2混合气体在相同实验条件下合成氨,使酚酞试液变红所需要的时间如下:
| N2和H2的体积比 | 5∶1 | 3∶1 | 1∶1 | 1∶3 | 1∶5 |
| 酚酞变红色所需时间/min | 8~9 | 7~8 | 6~7 | 3~4 | 9~10 |
据此回答下列问题:
(1)Y形管左侧管中发生反应的离子方程式________________________。
(2)铁粉撒在石棉绒上的目的是_________________________________ _______________________________________________________________________________________________________________。
(3)课外活动小组的同学们认为,该实验中即使酚酞变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是________________________。
请你另设计一个简单的实验验证你的理由____________________。欲解决这一问题,可以选用下图中的________装置连接在原装置中的________和________之间。
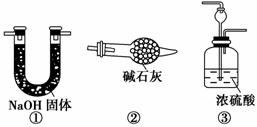
(4)在上述实验过程中,为尽快观察到酚酞试液变红的实验现象,应该控制N2和H2的体积比为________比较适宜;但该装置还难以实现此目的,原因是______________________________________。
(5)实验过程中通入试管C中的气体成分有________。
查看答案和解析>>
科目: 来源: 题型:
四川有丰富的天然气资源,以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):

请填写下列空白:
(1)已知0.5 mol甲烷与0.5 mol水蒸气在t ℃、p kPa时,完全反应生成一氧
化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是:
________________________________________________________________。
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气
体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气
和氢气。请运用化学反应速率和化学平衡的观点说明采取该措施的理由:
________________________________________________________________。
(3)当甲烷合成氨气的转化率为75%时,以5.60×107 L甲烷为原料能够合成
________L氨气。(假设体积均在标准状况下测定)
(4)已知尿素的结构简式为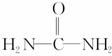 ,请写出两种含有碳氧双键的尿素
,请写出两种含有碳氧双键的尿素
的同分异构体的结构简式:
①_______________________________________________________________;
②_______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
A.采用较高压强(20~50 MPa)
B.采用500 ℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔
中,并补充N2和H2
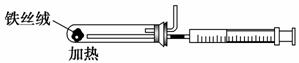
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。
(3)在298 K时,将10 mol N2和30 mol H2通入合成塔中,放出的热量小于924
kJ,原因是_________________________________________________________
_________________________________________________________________。
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现将氢气和氮气充入某密闭容器中,在一定条件下反应的有关数据为:
| 项目 | H2 | N2 | NH3 |
| 起始时 | 5 mol·L-1 | 3 mol·L-1 | 0 |
| 2 s末 | 2 mol·L-1 |
(1)氢气和氮气反应生成氨气(在2 s内)的反应速率v(H2)=__________。若此时已达平衡,则可求得平衡常数为__________。
(2)下图表示合成NH3反应在时间t0→t6中反应速率与反应过程曲线图,则在下列达到化学平衡的时间段中,化学平衡常数最大的一段时间是__________。
①t0→t1 ②t2→t3 ③t3→t4 ④t5→t6
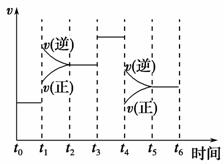
若t1时改变的条件是升高温度,则说明合成NH3反应的焓变ΔH________0(填“大于”或“小于”)。
查看答案和解析>>
科目: 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。

A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大
查看答案和解析>>
科目: 来源: 题型:
对于可逆反应N2(g)+3H2(g)2NH3(g) ΔH<0,下列说法正确的是( )。
A.达到平衡时反应物和生成物浓度一定相等
B.达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时大
C.达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以平衡向逆反应的方向移动
D.加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com