
科目: 来源: 题型:
关于原子轨道的说法正确的是 ( )。
A.凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道
混合起来而形成的
C.sp3杂化轨道是由同一原子中能量最近的s轨道和p轨道混合起来形成的
一组能量相同的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
查看答案和解析>>
科目: 来源: 题型:
某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%,其余为氧。
(1)X的分子式是________。
(2)X能与金属钠反应放出氢气,则X结构中含有的官能团的名称为________。
(3)X与空气中的氧气在催化剂作用下反应生成了Y,该反应的化学方程式是______________________,反应类型为________。
(4)X与高锰酸钾酸性溶液反应可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应生成132 g W,该反应的化学方程式为____________________________,其中X的转化率为________。
查看答案和解析>>
科目: 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
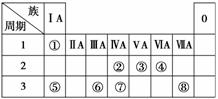
(1)④、⑤、⑥的原子半径由大到小的顺序是__________________________________________________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
_________________________________________________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________________________________________________________________
_________________________________________________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
查看答案和解析>>
科目: 来源: 题型:
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH
 CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
| C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 | |
| D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
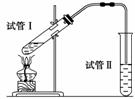 (1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是___________________________________________________________________
_________________________________________________________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是___________________________________________________________________
____________________________________________________(答出两条即可)。
查看答案和解析>>
科目: 来源: 题型:
沼气是一种廉价的能源。农村富有秸秆、杂草等废弃物,它们经微生物发酵之后,便可以产生沼气,可以用来点火做饭。
(1)已知(C6H10O5)n+nH2O―→3nCO2+3nCH4;反应放热。请评价这个反应的实际价值与意义:___________________________________________________________________
________________________________________________________(至少两点)。
(2)煤的主要成分是碳,写出煤和沼气中的主要成分燃烧过程中的化学方程式:_______________、_____________,对环境的污染较小的燃料是____________。
(3)若建立沼气发电站,则可以实现把________转化为电能。
查看答案和解析>>
科目: 来源: 题型:
(1)在固定体积的密闭容器中通入N2和H2,下列能说明达到平衡的是________。
A.3v(N2)=v(H2)
B.断裂1个N≡N的同时断裂6个N—H
C.N2、H2、NH3的物质的量之比是1∶3∶2
D.容器内气体的压强不变
E.气体的密度不变
F.气体的平均相对分子质量不变
(2)在2 L的密闭容器中通入2 mol N2、8 mol H2,5 min时达到平衡,测得NH3的物质的量是2 mol,则平衡时c(H2)=______________。
查看答案和解析>>
科目: 来源: 题型:
将0.2 mol两种气态烃组成的混合气体完全燃烧后得到6.72 L二氧化碳(标准状况下)和7.2 g水,下列说法正确的是
( )。
A.可能有乙烯 B.一定有甲烷
C.一定没有甲烷 D.可能有乙烷
查看答案和解析>>
科目: 来源: 题型:
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
( )。
A.正极附近SO 浓度逐渐增大
浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.负极反应式为Zn-2e-===Zn2+
D.该原电池工作过程中电解质溶液的pH增大
查看答案和解析>>
科目: 来源: 题型:
可逆反应2SO2+O2 2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是
2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是
( )。
A.v(SO2)=v′(SO2) B.v(O2)=v′(SO2)=v(SO3)
C.v(O2)=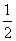 v′(SO2) D.v′(SO2)=v′(O2)=v′(SO3)
v′(SO2) D.v′(SO2)=v′(O2)=v′(SO3)
查看答案和解析>>
科目: 来源: 题型:
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述中,不正确的是
( )。
A.植物油能使溴的四氯化碳溶液褪色
B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生水解反应
D.所有的蛋白质遇浓硝酸均变黄色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com