
科目: 来源: 题型:
2011年5月21日,温家宝总理访问日本地震灾区,并承诺将支持日本重建工作。灾后重建需要大量的物质,下列有关说法正确的是( )
A.地震后很多地方发生了火灾,棉、麻、丝、毛的燃烧产物都只有CO2和H2O
B.灾区紧急供电需要用到汽油、柴油,石油经过常压蒸馏可得到汽油、柴油等燃料
C.灾区缺少食品,食品中的淀粉和纤维素的组成都可用(C6H10O5)n表示,它们互为同分异构体
D.灾民生活中需要的蛋白质、食用油、蔗糖等都是高分子化合物
查看答案和解析>>
科目: 来源: 题型:
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:
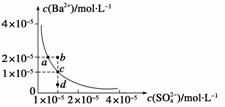
(1)下列说法正确的是__________。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(2)将100 mL 1 mol·L-1 H2SO4加入100 mL含Ba2+ 0.137 g 的溶液中充分反应后,过滤出沉淀,滤液中残留的Ba2+的物质的量浓度为____________。
(3)将沉淀用100 mL纯水和100 mL 0.01 mol·L-1的H2SO4分别洗涤,两种情况下损失的BaSO4的质量之比为________。
查看答案和解析>>
科目: 来源: 题型:
已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸K=1.75×10-5
次氯酸K=2.95×10-8
碳酸K1=4.30×10-7 K2=5.61×10-11
亚硫酸K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式K1=______。
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是________。等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为______________。
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________(填字母序号,下同)。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO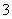 +HClO
+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-===HCO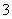
查看答案和解析>>
科目: 来源: 题型:
25 ℃时,将体积为Va、pH=a的某一元酸与体积Vb、pH=b的某一元碱混合,请完成下列各题。
(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7。由此你能得到的结论是________________________________________________________________________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00 mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11 mL。则b=________。
(3)若已知Va<Vb和a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是__________。
查看答案和解析>>
科目: 来源: 题型:
现有pH=2的醋酸甲和pH=2的盐酸乙:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动,若加入少量的冰醋酸,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动,若加入少量无水醋酸钠固体,待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为pH(甲)______pH(乙)(填“大于”、“小于”或“等于”,下同)。若将甲、乙两溶液等体积混合,溶液的pH=________。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)________V(乙)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)______c(CH3COO-)。
查看答案和解析>>
科目: 来源: 题型:
室温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
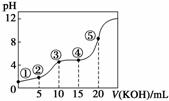 (1)点①所示溶液中,Kw=__________。
(1)点①所示溶液中,Kw=__________。
(2)点②所示溶液中的电荷守恒式为_________________。
(3)点③所示溶液中存在________种平衡。
(4)点④所示溶液中的物料守恒式为0.10 mol·L-1=
________________________________________________________________________。
(5)点⑤所示溶液中各离子浓度的大小顺序为____________________________________。
(6)上述5点所示溶液中,水的电离程度最大的是______,最小的是________(用序号回答)。
查看答案和解析>>
科目: 来源: 题型:
下列溶液中各微粒的浓度关系正确的是( )
A.pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH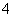 大小顺序为①>②>③
大小顺序为①>②>③
B.pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
C.0.2 mol·L-1的Na2CO3溶液:c(OH-)=c(HCO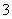 )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
D.0.2 mol·L-1 HCl与0.1 mol·L-1 NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
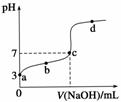 已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
A.a点表示的溶液中c(CH3COO-)略小于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中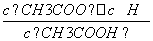 均等于K
均等于K
查看答案和解析>>
科目: 来源: 题型:
下列叙述中不正确的是( )
A.一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2OCH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
B.在常温下,10 mL 0.02 mol·L-1盐酸与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1 mol·L-1 NH4Cl溶液中:c(H+)+c(NH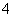 )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
D.5 mL 1 mol·L-1 CH3COONa溶液与5 mL 1 mol·L-1盐酸混合液中c(Cl-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com