
科目: 来源: 题型:
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00mol/L | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格 (粗、细)对该反应速率的影响. |
| ② | ||||
| ③ | ||||
| ④ |
(2)实验①中CO2质量随时间变化的关系见图:
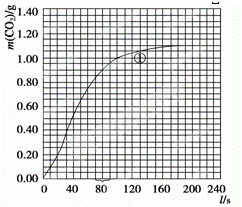
依据反应方程式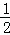 CaCO3+HNO3═
CaCO3+HNO3═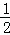 Ca(NO3)2+
Ca(NO3)2+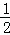 CO2↑+
CO2↑+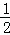 H2O,计算实验①在70~90s范围内HNO3的平均反应速率 (忽略溶液体积变化).
H2O,计算实验①在70~90s范围内HNO3的平均反应速率 (忽略溶液体积变化).
(3)请在框图中,画出实验②和③中CO2质量随时间变化关系的预期结果示意图.
查看答案和解析>>
科目: 来源: 题型:
2008年北京奥运会所用火炬燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷(C3H8),已知常温下1mol丙烷燃烧放出2220kJ热量,1mol正丁烷燃烧放出2878kJ热量,1mol异丁烷燃烧放出2869.6kJ热量.试回答下列问题:
(1)表示正丁烷燃烧的热化学反应方程式 ;
(2)下列有关说法正确的是 ;
A.奥运火炬燃烧时的能量转化主要是由化学能转变为热能
B.相同条件下,正丁烷的热值比丙烷大
C.正丁烷比异丁烷不稳定
D.异丁烷分子中的碳氢键比正丁烷的多
(3)已知1mol H2燃烧生成液态水放出热量是285.8kJ,现有5mol 氢气和丙烷的混合气体,完全燃烧时放热3847kJ,则氢气和丙烷的体积比为 .
查看答案和解析>>
科目: 来源: 题型:
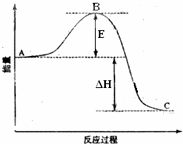
22SO2(g)+O2(g)⇌2SO3(g)反应过程的能量变化如图所示.
已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJ•mol﹣1.请回答下列问题:
(1)图中C表示 ;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是 ;
(2)图中△H= kJ•mol﹣1;
(3)如果反应速率υ(SO2)为0.05mol•L﹣1•min﹣1,则υ(O2)= mol•L﹣1•min﹣1;
(4)已知单质硫的燃烧热为296KJ•mol﹣1,计算由S(s)生成3mol SO3(g)的△H= .
查看答案和解析>>
科目: 来源: 题型:
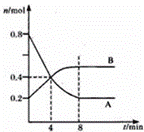
某温度时,在2L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)在4min末时,A、B的物质的量浓度c(A) c(B),从0~4min内A、B的物质的量浓度变化量△c(A) △c(B)(以上填“>”“<”或“=”).
(2)从反应开始至4min时,A的平均反应速率为 .
(3)该反应的化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
(1)氨气催化氧化生产硝酸,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2.已知:2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ•mol﹣1 N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol﹣1,则H2还原NO2生成水蒸气反应的热化学方程式是 .
(2)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92kJ•mol﹣1.请回答下列问题:
①取1mol N2(g)和3mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92kJ(填“大于”“等于”或“小于”),原因是 .
查看答案和解析>>
科目: 来源: 题型:
在铁片与稀硫酸的反应中,加入如下试剂或操作,可使生成氢气速率加快但生成氢气的量不变的是( )
|
| A. | 硫酸钠晶体 | B. | 不用稀硫酸,改用98%浓硫酸 |
|
| C. | 不用铁片,改用铁粉 | D. | 加热 |
查看答案和解析>>
科目: 来源: 题型:
已知反应:①101kPa时,C(s)+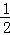 O2(g)=CO(g);△H1=﹣110.5kJ/mol②稀溶液中,H+(aq)+OH﹣(aq)=H2O(1);△H2=﹣57.3kJ/mol,下列结论正确的是( )
O2(g)=CO(g);△H1=﹣110.5kJ/mol②稀溶液中,H+(aq)+OH﹣(aq)=H2O(1);△H2=﹣57.3kJ/mol,下列结论正确的是( )
|
| A. | 若碳的燃烧热用△H3来表示,则△H3<△H1 |
|
| B. | 若碳的燃烧热用△H3来表示,则△H3>△H1 |
|
| C. | 稀硫酸与稀NaOH溶液反应的中和热△H=﹣57.3kJ/mol |
|
| D. | 浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
查看答案和解析>>
科目: 来源: 题型:
以NA代表阿伏加德罗常数.关于热化学方程式:C2H2(g)+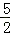 O2(g)=2CO2(g)+H2O(l)△H=﹣1300kJ/mol的说法正确的是
O2(g)=2CO2(g)+H2O(l)△H=﹣1300kJ/mol的说法正确的是
( )
|
| A. | 有10NA个电子转移时,该反应放出1300kJ的能量 |
|
| B. | 有NA个水分子生成且为液体时,吸收1300kJ的能量 |
|
| C. | 有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
|
| D. | 有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |
查看答案和解析>>
科目: 来源: 题型:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
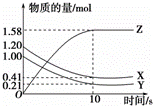
|
| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) |
|
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L |
|
| C. | 达平衡时Y的物质的量分数为:9.5% |
|
| D. | 反应的化学方程式为:X(g)+Y(g)⇌Z(g) |
查看答案和解析>>
科目: 来源: 题型:
一定条件下反应mA(g)+nB(g)⇌pC(g)+qD(g)在一密闭容器中进行,测得平均反应速率υ(C)=2υ(B),且反应前后容器内的压强不变,则m、n、p、q的数值是( )
|
| A. | 2、1、2、1 | B. | 3、1、2、2 | C. | 2、6、3、5 | D. | 1、3、2、2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com